Đề thi học kì 1 môn Hóa học lớp 10 Sở GD&ĐT Vĩnh Phúc năm học 2016 - 2017
Đề thi học kì 1 môn Hóa học lớp 10
Đề thi học kì 1 môn Hóa học lớp 10 Sở GD&ĐT Vĩnh Phúc năm học 2016 - 2017 là đề kiểm tra môn Hóa lớp 10 có đáp án đi kèm. Đây sẽ là tài liệu ôn tập môn Hóa lớp 10 hữu ích dành cho các bạn, giúp các bạn củng cố kiến thức, ôn thi học kì I hiệu quả.
Mời bạn làm online: Đề thi học kì 1 môn Hóa học lớp 10 Sở GD&ĐT Vĩnh Phúc năm học 2016 - 2017
Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Đa Phúc, Hà Nội năm học 2016 - 2017
Đề thi học kì 1 môn Ngữ văn lớp 10 Sở GD&ĐT Vĩnh Phúc năm học 2016 - 2017
Đề thi học kì 1 môn Toán lớp 10 Sở GD&ĐT Vĩnh Phúc năm học 2016 - 2017
|
SỞ GD&ĐT VĨNH PHÚC
|
ĐỀ KIỂM TRA HỌC KÌ I NĂM HỌC 2016 - 2017 MÔN: HÓA HỌC – LỚP 10 Thời gian làm bài: 45 phút, không kể thời gian giao đề |
Cho nguyên tử khối: H = 1; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Br = 80; Ba = 137.
I. PHẦN TRẮC NGHIỆM (2,0 điểm)
Câu 1: Chất nào sau đây chứa liên kết ion?
A. N2. B. CH4. C. KCl. D. NH3.
Câu 2: Tổng số hạt mang điện trong nguyên tử X là 112. Số proton trong X là
A. 112. B. 56. C. 48. D. 55.
Câu 3: Nguyên tố X thuộc chu kì 3, nhóm IIA trong bảng tuần hoàn. Ở trạng thái cơ bản, số lớp electron của X là
A. 3. B. 1. C. 4. D. 2.
Câu 4: Thứ tự tăng dần tính phi kim của các nguyên tố trong nhóm VIIA là
A. Br, F, I, Cl. B. F, Cl, Br, I. C. I, Br, F, Cl. D. I, Br, Cl, F.
Câu 5: Cấu hình electron nào sau đây là của nguyên tố kim loại?
A. 1s22s22p63s23p6. B. 1s22s22p63s23p3. C. 1s22s22p63s23p1. D. 1s22s22p63s23p5.
Câu 6: Số oxi hóa của lưu huỳnh trong SO2 bằng
A. - 2. B. +4. C. +2. D. +6.
Câu 7: Nguyên tử kali có 19 proton, 19 electron và 20 nơtron. Số khối của nguyên tử kali là
A. 20. B. 19. C. 38. D. 39.
Câu 8: Vị trí của flo (Z = 9) trong bảng tuần hoàn là
A. ô số 9, chu kì 2, nhóm VIIA. B. ô số 9, chu kì 2, nhóm VA.
C. ô số 7, chu kì 3, nhóm VIIA. D. ô số 7, chu kì 2, nhóm VA.
II. PHẦN TỰ LUẬN (8,0 điểm)
Câu 9 (2,0 điểm): Hạt nhân nguyên tử X có 8 proton; nguyên tử Y có tổng số hạt mang điện bằng 52.
a) Viết cấu hình electron của X, Y.
b) Viết cấu hình electron của Y2+; Y3+.
Câu 10 (2,0 điểm): Cân bằng các phản ứng sau theo phương pháp thăng bằng electron
a) C + HNO3 → CO2+ NO2 + H2O
b) Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + H2O
Câu 11 (1,5 điểm): Trong tự nhiên đồng có hai đồng vị là 6329Cu và 6529Cu. Tính phần trăm số nguyên tử của mỗi đồng vị biết nguyên tử khối trung bình của đồng là 63,54 đvC.
Câu 12 (2,5 điểm): Nguyên tố X thuộc nhóm VIA trong bảng tuần hoàn. Phần trăm khối lượng của X trong oxit cao nhất là 40%.
a) Tìm nguyên tố X.
b) Gọi Y là hiđroxit cao nhất của X. Viết công thức cấu tạo của Y (thỏa mãn qui tắc bát tử) và viết phương trình phản ứng của Y với K2CO3; BaCl2.
Đáp án đề thi học kì 1 môn Hóa học lớp 10
A. Trắc nghiệm (2,0 điểm): 0.25đ/câu
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Đáp án |
C |
B |
A |
D |
C |
B |
D |
A |
B. Tự luận (8,0 điểm).
Câu 9 (2,0 điểm)
a) Cấu hình e của X: 1s22s22p4
+ Vì số hạt mang điện của Y là 52 nên số electron của ![]()
→ Cấu hình e của Y: 1s22s22p63s23p63d64s2
b) Cấu hình e của Y2+: 1s22s22p63s23p63d6
+ Cấu hình e của Y3+: 1s22s22p63s23p63d5
Câu 10 (2,0 điểm)
a) C + 4HNO3 → CO2 + 4NO2 + 2H2O
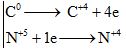
b) Cu2S + 14HNO3 → 2Cu(NO3)2 + H2SO4 + 10NO2 + 6H2O
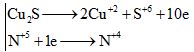
Câu 11 (1,5 điểm)
Đặt x, y lần lượt là % số nguyên tử của 6329Cu và 6529Cu ta có
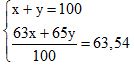
→ x = 73; y = 27 % số nguyên tử của 6329Cu và 6529Cu là 73% và 27%
Câu 12 (2,5 điểm)
a) Vì X thuộc nhóm VIA nên hóa trị cao nhất của X với oxi bằng 6
→ Oxit cao nhất của X là XO3
+ Theo giả thiết ta có: ![]() X là lưu huỳnh.
X là lưu huỳnh.
b) Hiđroxit cao nhất của X là H2SO4 có CTCT

+ Phản ứng xảy ra
K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
BaCl2 + H2SO4 → BaSO4↓ + 2HCl



