Đề thi học kì 2 lớp 10 môn Hóa học Chân trời sáng tạo năm 2023 - Đề 6
Hóa học 10 Chân trời sáng tạo
Lớp:
Lớp 10
Môn:
Hóa Học
Dạng tài liệu:
Đề thi
Bộ sách:
Chân trời sáng tạo
Loại File:
PDF
Phân loại:
Tài liệu Tính phí
ĐỀ ÔN TẬP KIỂM TRA CUỐI HỌC KỲ II NĂM HỌC 2022-2023 - ĐỀ 6
MÔN: HÓA HỌC 10
Câu 1: Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử
A. CH
4
B. H
2
O C. PH
3
D. H
2
S
Câu 2: Hợp chất nào dưới đây không tạo được liên kết hydrogen liên phân tử
A. CH
4
B. H
2
O C. NH
3
D. HF
Câu 3: Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên
A. một ion dương B. một ion âm
C. một lưỡng cực vĩnh viễn D. một lưỡng cực tạm thời
Câu 4: Loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện
lớn, thường là F, O, N) với một nguyên tử khác (có độ âm điện lớn thường là F, O, N) còn cặp electron
hóa trị chưa tham gia liên kết là
A. liên kết ion. B. liên kết cộng hóa trị có cực.
C. liên kết hydrogen. D. liên kết cộng hóa trị không cực.
Câu 5: Liên kết hydrogen và tương tác van der Waals làm
A. tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
B. giảm nhiệt độ nóng chảy và tăng nhiệt độ sôi của các chất.
C. giảm nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
D. tăng nhiệt độ nóng chảy và giảm nhiệt độ sôi của các chất.
Câu 6: Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất
A. Kr. B. Ne. C. Ar. D. Xe.
Câu 7: So sánh nhiệt độ sôi và nhiệt độ nóng chảy của các chất F
2
, Cl
2
, Br
2
, I
2
.
A. Nhiệt độ sôi và nhiệt độ nóng chảy: F
2
> Br
2
> I
2
> Cl
2
.
B. Nhiệt độ sôi và nhiệt độ nóng chảy: F
2
> Cl
2
> Br
2
> I
2
.
C. Nhiệt độ sôi và nhiệt độ nóng chảy: F
2
< Br
2
< I
2
< Cl
2
.
D. Nhiệt độ sôi và nhiệt độ nóng chảy: F
2
< Cl
2
< Br
2
< I
2
.
Câu 8: Nguyên nhân làm cho các liên kết phân cực là
A. sự chênh lệch năng lượng liên kết. B. do bán kính của nguyên tử.
C. do liên kết hidro trong phân tử. D. sự chênh lệch độ âm điện lớn.
Câu 9: Tương tác van der Waals tăng khi
A. khối lượng phân tử giảm, kích thước phân tử tăng. B. khối lượng phân tử tăng, kích thước phân tử giảm.
C. khối lượng phân tử tăng, kích thước phân tử tăng. D. khối lượng phân tử giảm, kích thước phân tử
giảm.
Câu 10: Giữa nước và HF có thể tạo ra ít nhất được bao nhiêu kiểu liên kết hydrogen?
A. 2. B. 5. C. 4. D. 3.
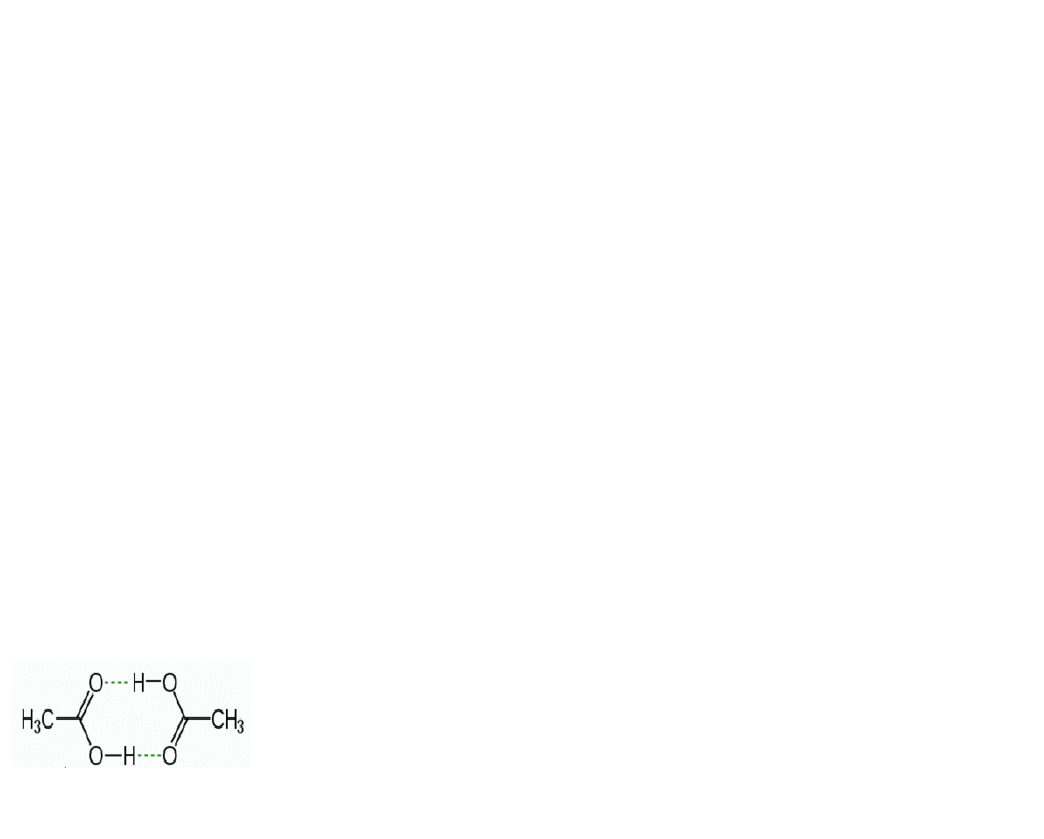
Câu 11: Cho sơ đồ liên kết giữa hai phân tử acid CH
3
COOH:
Trong sơ đồ trên, đường nét đứt đại diện cho
A. liên kết hydrogen. B. liên kết ion. C. liên kết cho – nhận. D. liên kết cộng hóa trị
có cực.
Câu 12: Chất khử là chất
A. cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 13: Chất oxi hóa là chất
A. cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 14: Quá trình oxi hóa( Sự oxi hóa) là quá trinh
A. chất oxi hóa cho electron B. chất khử cho electron
C. chất khử nhận electron D. chất oxi hóa nhận electron
Câu 15: Quá trình khử( Sự khử) là quá trinh
A. chất oxi hóa cho electron B. chất khử cho electron
C. chất khử nhận electron D. chất oxi hóa nhận electron
Câu 16: Cho quá trình : Fe
+ 2
Fe
+3
+ 1e. Đây là quá trình gì?
A. Quá trình oxi hóa. B. Quá trình khử . C. Quá trình nhận proton. D. tự oxi hóa –
khử.
Câu 17: Cho quá trình : N
+5
+3e
N
+2
. Đây là quá trình gì?
A. Quá trình oxi hóa. B. Quá trình khử . C. Quá trình nhận proton. D. tự oxi hóa –
khử.
Câu 18: Quá trình khử nào không đúng?
A. + 4e B. + 4e
C. +2e D. +4e
Câu 19: Cho phản ứng: 2Na + Cl
2
→ 2NaCl. Trong phản ứng này, nguyên tử sodium
A. bị oxi hóa B. bị khử C . vừa bị oxi hóa, vừa bị khử D. môi
trường
Câu 20: Cho phản ứng: Zn + 2HCl → ZnCl
2
+ H
2
Trong phản ứng này, chất oxi hóa là
A. Zn B. HCl C . ZnCl
2
D. H
2
Câu 21: Trong phản ứng Cl
2
(k) + 2KBr (dd) → Br
2
(l) + 2KCl(dd), phân tử Cl
2
đã
A. bị khử. B. bị oxi hóa.
C. không bị oxi hóa và không bị khử. D. bị oxi hóa và bị khử.
Câu 22: Cho phương trình phản ứng: aAl + bH
2
SO
4
→ Al
2(
SO
4
)
3
+ d SO
2
+ e H
2
O Tỉ lệ a:b là
A. 2:3 B. 1:1 C. 1:3 D. 1:2
Câu 23: Cho phản ứng: H
2
S + KMnO
4
+ H
2
SO
4
→ H
2
O + S + MnSO
4
+ K
2
SO
4
. Hệ số của các chất khử
trong phản ứng trên lần lượt là:
A. 2 B. 5 C. 3 D. 1
Câu 24: Trong phản ứng : Zn(r) + Pb
2+
(dd) → Zn
2+
(dd) + Pb(r) Ion Pb
2+
đã
A. cho 2 electron. B. nhận 2 electron. C. cho 1 electron. D. nhận 1
electron
Câu 25: Trong phản ứng : Zn(r) + Pb
2+
(dd) → Zn
2+
(dd) + Pb(r) Nguyên tử Zn đã
A. cho 2 electron. B. nhận 2 electron. C. cho 1 electron. D. nhận 1
electron
Câu 26: Nguyên tư
̉
S đo
́
ng vai tro
̀
vư
̀
a la
̀
châ
́
t khư
̉
, vư
̀
a la
̀
châ
́
t oxi hoa
́
trong pha
̉
n ư
́
ng na
̀
o sau đây?
A. 4S + 6NaOH
(đặc)
0
t
2Na
2
S + Na
2
S
2
O
3
+ 3H
2
B. S + 3F
2
0
t
SF
6
C. S + 6HNO
3 (đặc)
0
t
H
2
SO
4
+ 6NO
2
+ 2H
2
O D. S + 2Na
0
t
Na
2
S
Câu 27: Số mol electron sinh ra khi có 2,5mol Cu bị oxi hóa thành Cu
2+
là :
A. 2,50 mol electron. B. 1,25 mol electron C. 0,50 mol electron. D. 5,00 mol
electron
Câu 28: Cho sơ đồ phản ứng: aCu + bHNO
3
dCu(NO
3
)
2
+ eNO
2
+ fNO + gH
2
O
a, b,d,e,f g là các số nguyên tối giản và tỉ số e:f = 3:2 thì giá trị b bằng
A. 7 B. 28. C. 15. D. 24.
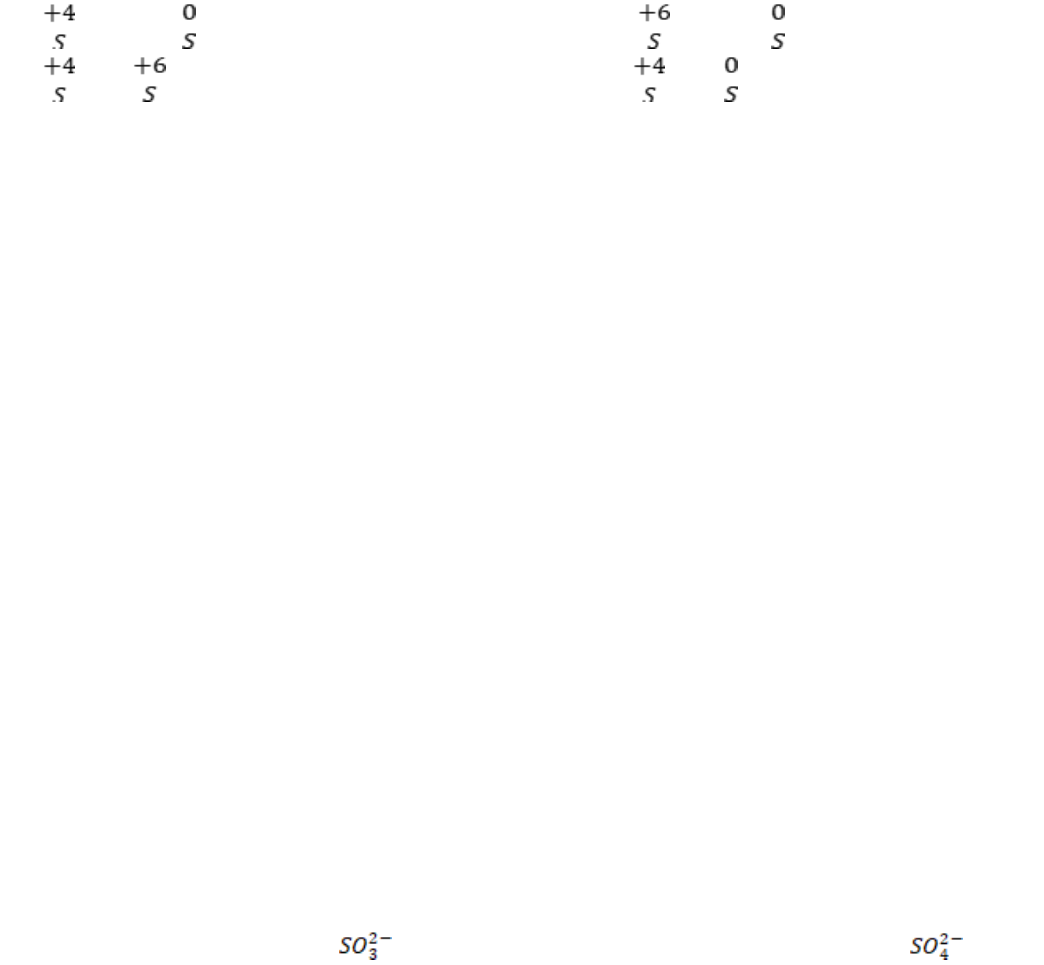
Câu 29: Sulfur trong hợp chất(ion) nào sau đây có số oxi hoá là +4?
A. H
2
S. B. . C. H
2
SO
4
. D. .
Câu 30: Hàm lượng iron (II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium
permanganate theo sơ đồ sau: FeSO
4
+ KMnO
4
+ H
2
SO
4
→ Fe
2
(SO
4
)
3
+ K
2
SO
4
+ MnSO
4
+ H
2
O
Thể tích KMnO
4
0,02M để phản ứng vừa đủ 20 ml dung dịch FeSO
4
0,1M là
A. 20 ml. B. 30 ml. C. 40 ml. D. 50 ml.
Câu 31: Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất, kí hiệu là
A. Δr B. Δf C. Δs D. Δ
G
Câu 32: Biến thiên Enthalpy chuẩn (hay nhiệt tạo thành chuẩn) của phản ứng, kí hiệu là
A. Δr B. Δf C. Δs D. Δ
G
Câu 33: Cho phản ứng : 4Na(s) + O
2
(g) → 2Na
2
O(s) Δr =−836kJ
Enthalpy tạo thành của Na
2
O rắn ở điều kiện chuẩn là
A. – 836 kJ/ mol. B. + 836 kJ/ mol. C. – 418 kJ/ mol. D. + 418 kJ/ mol.
Câu 34: Cho phương trình nhiệt hóa học của phản ứng:
2H
2
(g)+O
2
(g)→2H
2
O(l) Δr =-571kJ Phản ứng trên là phản ứng
A. thu nhiệt B. tỏa nhiệt
C. không có sự thay đổi năng lượng D. có sự hấp thụ nhiệt lượng từ môi trường xung
quanh.
Câu 35: Cho phương trình nhiệt hóa học của phản ứng
N2(g)+O2(g)→2NO(g) Δr =+179,20kJ Phản ứng trên là phản ứng
A. thu nhiệt B. không có sự thay đổi năng lượng
C. tỏa nhiệt D. có sự giải phóng nhiệt lượng ra môi trường
Câu 36: Điều kiện nào sau đây không phải là điều kiện chuẩn?
A. Áp suất 1 bar và nhiệt độ 25
o
C hay 298K. B. Áp suất 1 bar và nhiệt độ 298K
C. Áp suất 1 bar và nhiệt độ 25
o
C D. Áp suất 1 bar và nhiệt độ 25K
Câu 37: Enthalpy tạo thành chuẩn của các đơn chất bền bằng
A. +1 kJ/ mol. B. -1 kJ/ mol. C. +2 kJ/ mol. D. 0 kJ/ mol.
Câu 38: Nhiệt kèm theo (nhiệt lượng toả ra hay thu vào) của một phản ứng hóa học trong điều kiện chuẩn gọi là
A. enthalpy tạo thành chuẩn của một chất. B. enthalpy tạo thành của một chất.
C. biến thiên enthalpy chuẩn của phản ứng hoá học. D. biến thiên enthalpy của phản ứng.
Câu 39: Nhiệt kèm theo (nhiệt lượng toả ra hay thu vào) phản ứng tạo thành 1mol chất đó từ các đơn chất bền trong
điều kiện chuẩn gọi là
A. enthalpy tạo thành chuẩn của một chất. B. enthalpy tạo thành của một chất.
C. biến thiên enthalpy chuẩn của phản ứng hoá học. D. biến thiên enthalpy của phản ứng.
Câu 40: Cho các phản ứng sau:
(a) C(s) + O
2
(g) → CO
2
(g) Δr =−393,5kJ
(b) 2Al(s)+32O2(g)→Al2O3(s) Δr =−1675,7kJ
(c) CH
4
(g) + H
2
O(l) → CO(g) + 3H
2
(g) Δr =+249,9kJ
(d) H
2
(g) + I
2
(s) → 2HI(g) Δr =+53kJ.
(e) 4Na(s) + O
2
(g) → 2Na
2
O(s) Δr =−836kJ
Số phản ứng toả nhiệt là
A. 2 B. 3. C. 4. D. 5.
Câu 41: Cho phản ứng đốt cháy ethane: C
2
H
6
(g) + 7/2 O
2
(g) 2CO
2
(g) + 3H
2
O (l)
Biết:
Chất
C
2
H
6 (g)
O
2 (g)
CO
2 (g)
H
2
O
(l)
Δ
f
-87,1
0
-393,5
-285,8
Biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane là
A. - 1557,3 (kJ). B. +1557,3(kJ). C. - 1644,4 (kJ). D. +1644,4 (kJ).
Câu 42: Cho giản đồ sau:
Đề thi cuối học kì 2 lớp 10 môn Hóa học Chân trời sáng tạo năm 2023 - Đề 6
VnDoc.com xin gửi tới bạn đọc bài viết Đề thi học kì 2 lớp 10 môn Hóa học Chân trời sáng tạo năm 2023 - Đề 6 để bạn đọc cùng tham khảo và có thêm tài liệu ôn thi học kì 2 lớp 10. Mời các bạn cùng theo dõi bài viết dưới đây nhé.
Đề thi được tổng hợp gồm có 45 câu hỏi trắc nghiệm. Thí sinh làm bài trong thời gian 45 phút. Mong rằng qua bài viết này bạn đọc có thêm tài liệu để học tập tốt hơn môn Hóa học lớp 10 Chân trời sáng tạo. Mời các bạn cùng tham khảo thêm tại mục Đề thi học kì 2 lớp 10 môn Hóa học Chân trời sáng tạo.



