Đề thi học kì 2 môn Hóa 10 sách Cánh diều Cấu trúc mới
Đề thi học kì 2 lớp 10 môn Hóa sách Cánh diều năm 2025
Đề thi học kì 2 môn Hóa 10 sách Cánh diều Cấu trúc mới gửi tới bạn đọc gồm Ma trận, đề thi kèm theo hướng dẫn chấm. Nội dung câu hỏi bám sát chương trình học kì 2 môn Hóa học 10.
Cấu trúc đề thi gồm có 2 phần:
- Phần 1. Trắc nghiệm (3 dạng câu hỏi)
+ Câu hỏi nhiều đáp án lựa chọn
+ Câu hỏi đúng - sai
+ Câu hỏi trả lời ngắn
- Phần 2. Tự luận
|
SỞ GIÁO DỤC VÀ ĐÀO TẠO TRƯỜNG THPT………………. Đề 1 |
ĐỀ KIỂM TRA HỌC KÌ II Môn: HÓA HỌC 10 Thời gian làm bài … phút, không kể thời gian giao đề |
Họ và tên học sinh: …………………………………… Lớp: 10 …………………
Cho nguyên tử khối của các nguyên tố: H=1, C=12, O=16, Li=7, Na=23, Mg=24, Al=27, S = 32, Cl =35,5, K=39, Ca=40, Fe=56, Cu=64, Ba=137
PHẦN I: TRẮC NGHIỆM KHÁCH QUAN (8,5 điểm)
1. Câu hỏi trắc nghiệm nhiều phương án lựa chọn (4,5 điểm). Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Fe2O3 là thành phần chính của quặng hematite đỏ, dùng để luyện gang. Số oxi hóa của iron (sắt) trong Fe2O3 là:
A. -3.
B. +3.
C. 3.
D. 3+.
Câu 2: Yếu tố nào dưới đây không ảnh hưởng đến tốc độ phản ứng:
A. Nhiệt độ chất phản ứng.
B. Thể vật lí của chất phản ứng (rắn, lỏng, kích thước lớn, nhỏ, …).
C. Nồng độ chất phản ứng.
D. Tỉ trọng của chất phản ứng.
Câu 3: Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ của phản ứng rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
A. Chất xúc tác.
B. Nồng độ.
C. Áp suất.
D. Nhiệt độ.
Câu 4: Cho phương trình nhiệt hoá học sau: N2(g) + O2(g) → 2NO(g),
Nhiệt tạo thành chuẩn của NO(g) là
A. +180,6 kJ/ mol.
B. –180,6 kJ/mol.
C. +90,3 kJ/mol.
D. –90,3 kJ/mol.
Câu 5: Cấu hình electron nguyên tử thuộc nguyên tố halogen là:
A. ns2np2
B. ns2np3
C. ns2np5
D. ns2np6.
Câu 6: Trong phản ứng oxi hóa – khử
A. chất bị oxi hóa nhận electron và chất bị khử cho electron.
B. quá trình oxi hóa và khử xảy ra đồng thời.
C. chất chứa nguyên tố số oxi hóa cực đại luôn là chất khử.
D. quá trình nhận electron gọi là quá trình oxi hóa
Câu 7: Hỗn hợp tecmit dùng hàn gắn đường ray có thành phần chính là aluminium (Al) và iron (III) oxide (Fe2O3). Phản ứng xảy ra khi đung nóng hỗn hợp tecmit như sau:
2Al + Fe2O3 ![]() \(\overset{t^{o} }{\rightarrow}\) Al2O3 + 2Fe .
\(\overset{t^{o} }{\rightarrow}\) Al2O3 + 2Fe .
Phát biểu nào dưới đây là đúng? Phát biểu nào dưới đây là đúng?
A. Al2O3 là chất nhận electron.
B. Fe2O3 là chất nhường electron.
C. Al là chất bị oxi hoá.
D. Fe là chất nhận electron
Câu 8: Chất hay ion nào có tính khử mạnh nhất?
A. Cl2
B. Cl-
C. I2
D. I-
Câu 9: Hydrogen halide nào sau đây có nhiệt độ sôi cao nhất?
A. HF.
B. HCl.
C. HBr.
D. HI.
Câu 10: Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ tăng lên bao nhiêu lần khi nâng nhiệt độ từ 20oC lên 50oC?
A. 2 lần.
B. 8 lần.
C. 16 lần.
D. 32 lần
Câu 11: Cho các phản ứng sau:
(1) Phản ứng trung hoà acid – base: HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l).
(2) Phản ứng nung vôi: CaCO3(s) ![]() \(\overset{t^{o} }{\rightarrow}\) CaO(s) + CO2(g).
\(\overset{t^{o} }{\rightarrow}\) CaO(s) + CO2(g).
Nhận xét nào sau đây là đúng?
A. Cả hai là phản ứng toả nhiệt.
B. Cả hai là phản ứng thu nhiệt.
C. Phản ứng (1) tỏa nhiệt, (2) thu nhiệt.
D. Phản ứng (1) thu nhiệt, (2) tỏa nhiệt.
Câu 12: Hãy cho biết yếu tố nồng độ đã được áp dụng cho quá trình nào sau đây?
A. Khi ủ bếp than, người ta đậy nắp bếp lò làm cho phản ứng cháy của than chậm lại.
B. Phản ứng oxi hóa SO2 thành SO3 diễn ra nhanh hơn khi có mặt V2O5.
C. Bột nhôm (aluminum) phản ứng với dung dịch HCl nhanh hơn so với dây nhôm.
D. Người ta chẻ nhỏ củi để bếp lửa cháy mạnh hơn
Câu 13. Hít thở không khí có chứa khí nào sau đây vượt ngưỡng 30 μg/m3 không khí (QCVN 06:2009/BTNMT) sẽ tiềm ẩn nguy cơ gây viêm đường hô hấp, co thắt phế quản, khó thở?
A. O2
B. Cl2
C. N2
D. O3
Câu 14. Cho các phát biểu sau:
a) Đơn chất chlorine có tính oxi hóa mạnh hơn đơn chất bromine và
b) Tương tác van der Walls của các đơn chất halogen tăng từ fluorine đến iodine đã góp phần làm tăng nhiệt độ sôi của chúng.
c) Thành phần của nước bromine gồm các chất: Br2, H2O, HBr và
d) Đơn chất iodine phản ứng được với nước và với dung dịch sodium bromide.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 15: Cho phản ứng phân hủy N2O5 như sau: 2N2O5(g) → 4NO2(g) + O2(g).Tại thời điểm ban đầu, nồng độ của N2O5 là 0,02M; Sau 100s, nồng độ N2O5 còn 0,0169M.Tốc độ trung bình của phản ứng phân hủy N2O5 trong 100s đầu tiên là
A. 1,55.10-5 (mol/ (L.s)).
B. 1,55.10-5 (mol/ (L.min)).
C. 1,35.10-5 (mol/ (L.s)).
D. 1,35.10-5 (mol/ (L.min)).
Câu 16. Chlorine vừa là chất oxi hoá, vừa là chất khử trong phản ứng hoá học nào sau đây?
A. H2 + Cl2 ![]() \(\overset{t^{o} }{\rightarrow}\) 2HCl
\(\overset{t^{o} }{\rightarrow}\) 2HCl
B. HCl + NaOH → NaCl + H2O
C. 2KMnO4 + 16HCl ![]() \(\overset{t^{o} }{\rightarrow}\) 2MnCl2 + 2KCl + 5Cl2 + 8H2O
\(\overset{t^{o} }{\rightarrow}\) 2MnCl2 + 2KCl + 5Cl2 + 8H2O
D. Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 17. Biểu đồ sau biểu diễn nhiệt độ sôi của các hydrogen halide
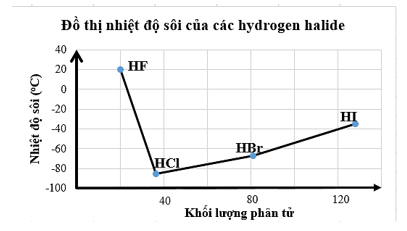
Nhận định nào sau đây là đúng?
- Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử nên nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại.
- Nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại là do lực tương tác van der Waals của HF lớn hơn.
- Nhiệt độ sôi tăng dần từ HF đến HI do khối lượng phân tử tăng dẫn đến tương tác van der Waals tăng.
- Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI là do khối lượng phân tử tăng dẫn đến liên kết hydrogen liên phân tử tăng dần
Câu 18. Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hoá học sau:
2H2(g) + O2(g) ![]() \(\overset{t^{o} }{\rightarrow}\) 2H2O(g) (1)
\(\overset{t^{o} }{\rightarrow}\) 2H2O(g) (1) ![]() \(\triangle H_{298}^{0} =-483,64kJ\)
\(\triangle H_{298}^{0} =-483,64kJ\)
Cho các phát biểu sau:
a) Biến thiên enthalpy chuẩn của phản ứng là 483,64
b) Khi tạo thành 27 gam nước (gas) thì phản ứng đã cung cấp cho môi trường một lượng nhiệt là +725,46kJ.
c) Tổng năng lượng của hỗn hợp 1 mol oxygen (gas) và 2 mol hydrogen (gas) có năng lượng lớn hơn năng lượng của 2 mol nước (hơi).
d) Enthalpy tạo thành chuẩn của H2O (g) là –241,82 kJ/mol.
Số phát biểu đúng là
A. 1.
B. 3.
C. 4.
D. 2.
2. Câu hỏi trắc nghiệm đúng sai (3,0 điểm). Thí sinh trả lời từ câu 1 đến câu 2. Trong mỗi ý a); b); c); d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Phản ứng 2NO(g) + O2(g) → 2NO2(g) có tốc độ phản ứng phù hợp với biểu thức ν = k[NO]2[O2].
a) Nếu nồng độ của NO và O2 đều tăng 3 lần thì tốc độ phản ứng sẽ tăng 9 lần.
b) Nếu thể tích của bình phản ứng đột ngột giảm một nửa thì áp suất của các khí NO và O2 cũng giảm đi.
c) Nếu nồng độ của NO giảm 2 lần, giữ nguyên nồng độ O2 thì tốc độ sẽ giảm 4 lần.
d) Nếu thể tích của bình phản ứng đột ngột giảm một nửa thì tốc độ phản ứng tăng gấp 8 lần so với khi chưa giảm thể tích.
Câu 2. Biến thiên enthalpy tạo thành chuẩn của các hydrogen halide được cho trong bẳng sau:
|
Chất |
HF (g) |
HCl (g) |
HBr(g) |
HI (g) |
|
|
–273,3 |
–92,3 |
–36,3 |
26,5 |
a) Phản ứng H2(g) + Cl2(g) → 2HCl (g) có ![]() \(\triangle H_{298}^{0} =-92,3kJ\).
\(\triangle H_{298}^{0} =-92,3kJ\).
b) Năng lượng liên kết HX giảm dần từ H–F đến H–I.
c) Phản ứng phân hủy HI: 2HI (g) → H2(g) + I2(g) là phản ứng tỏa nhiệt.
d) Trong phản ứng giữa halogen và hydrogen, nhiệt lượng tỏa ra tăng dần từ F2 đến I2.
Câu 3: Một bạn học sinh thực hiện hai thí nghiệm: Một bạn học sinh thực hiện hai thí nghiệm:
Thí nghiệm 1: Cho 100 mL dung dịch acid HCl vào cốc (1), sau đó thêm một mẫu kẽm và đo tốc độ khí H2 thoát ra theo thời gian.
Thí nghiệm 2: (lặp lại tương tự thí nghiệm 1): 100 mL dung dịch acid HCl khác được cho vào cốc (2) rồi cũng thêm một mẫu kẽm vào và lại đo tốc độ khí hydrogen thoát ra theo thời gian.
Bạn học sinh đó nhận thấy tốc độ thoát khí hydrogen ở cốc (2) nhanh hơn ở cốc (1). Từ đó bạn học sinh đưa một số nhận định sau:
a) Phản ứng ở cốc (2) nhanh hơn nhờ có chất xúc tác.
b) Lượng kẽm ở cốc (1) nhiều hơn ở cốc (2).
c) Acid HCl ở cốc (1) có nồng độ thấp hơn acid ở cốc (2).
d) Kẽm ở cốc (2) được nghiền nhỏ còn kẽm ở cốc (1) ở dạng viên
Câu 4: Trong công nghiệp, dung dịch sodium chlorine được đem điện phân để có phản ứng theo phương trình hóa học sau: NaCl(aq) + H2O(l) → A(aq) + X(g) + Y(g) (*).
Biết X chứa nguyên tố không thuộc nhóm VIIA.
a) Công thức hóa học lần lượt của A, X, Y là NaOH, H2 và Cl2.
b) Từ phản ứng kết hợp giữa X và Y sẽ sản xuất được hydrogen
c) Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến là nước
d) Trong phản ứng (*), NaCl đóng vai trò là chất khử, H2O đóng vai trò chất oxi hóa.
2. Câu trắc nghiệm yêu cầu trả lời ngắn (1,0 điểm). Thí sinh trả lời từ câu 1 dến câu 4.
Câu 1. Cho các chất sau: KF, KOH, KCl, KBr, KI, KMnO4. Có bao nhiêu chất bị oxi hóa khi tác dụng với dung dịch sulfuric acid đặc?
Câu 2. Tốc độ của một phản ứng có dạng: (với A, B là 2 chất khác nhau). Nếu tăng nồng độ A lên 3 lần và giữ nguyên nồng độ của B thì tốc độ phản ứng tăng 9 lần. Giá trị của x là bao nhiêu?
Câu 3. Trong quá trình quang hợp, thực vật sử dụng năng lượng từ ánh sáng mặt trời để tạo thành glucose (C6H12O6) và oxygen từ khí CO2 và H2O. Biến thiên enthalpy của quá trình quang hợp này là 673 kJ cho 1 mol glucose. Tính năng lượng ánh sáng (kJ) cần có để tạo ra 36 g đường glucose, biết hiệu suất của quá trình quang hợp của loại cây này là 20%.
Câu 4. Nghiền mịn 10 g một mẫu đá vôi trong tự nhiên, hòa tan trong lượng dư dung dịch HCl thu được 4 g khí carbonic. Hàm lượng phần trăm calcium carbonate trong mẫu đá vôi là bao nhiêu?
PHẦN II. TỰ LUẬN (1,5 điểm)
Câu 1 (0,5 điểm)
Trình bày phương pháp hóa học để nhận biết bốn dung dịch đựng trong 4 lọ riêng NaF, NaCl, NaBr, NaI.
Câu 2. (1,0 điểm) Bromine là nguyên liệu điều chế các hợp chất chứa bromide trong y dược, nhiếp ảnh, chất nhuộm, chất chống nổ cho động cơ đốt trong, thuốc trừ sâu,… Để sản xuất bromine từ nguồn nước biển có hàm lượng 82,4 gam NaBr/m3 nước biển người ta dùng phương pháp thổi khí chlorine vào nước biển. Lượng khí chlorine cần dùng phải nhiều hơn 15% so với lí thuyết. Tính khối lượng khí chlorine cần dùng để điều chế bromine có trong 2200 m3 nước biển
-----------------HẾT---------------
Thí sinh không được sử dụng tài liệu; Giám thị không giải thích gì thêm
Chi tiết đáp án nằm trong FILE TẢi VỀ








