Điền từ thích hợp vào chỗ trống: “Số … là số đặc trưng của một nguyên tố hóa học”.
Số proton là số đặc trưng của một nguyên tố hóa học.
Cùng nhau ôn tập, củng cố kiến thức thông qua bài Luyện tập Nguyên tố nha!
Điền từ thích hợp vào chỗ trống: “Số … là số đặc trưng của một nguyên tố hóa học”.
Số proton là số đặc trưng của một nguyên tố hóa học.
Hiện nay, số nguyên tố hóa học trong tự nhiên là
Hiện nay có 98 nguyên tố hóa học trong tự nhiên.
Kí hiệu hóa học của kim loại Aluminium là
Kí hiệu hóa học của kim loại Aluminium là Al
Carbon: C
Calcium: Ca
Zinc: Zn
Nguyên tố hóa học là tập hợp các nguyên tử cùng loại có …
Nguyên tố hóa học là tập hợp các nguyên tử cùng loại có cùng số proton trong hạt nhân.
Biết rằng 4 nguyên tử magnesium nặng bằng 3 nguyên tử nguyên tố X. Kí hiệu hóa học của nguyên tố X là:
Theo bài ra ta có:
(NTK Mg). 4 = (NTK X).3
⇔ 24 . 4 = (NTK X).3 ⇔ NTK X = 32 (amu).
Vậy nguyên tố X là lưu huỳnh (sulfur), kí hiệu là S.
Đây là sơ đồ nguyên tử của nguyên tố nào?
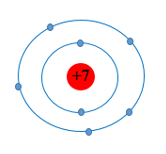
Dựa vào số electron của nguyên tử nguyên tố
Theo sơ đồ nguyên tử có 7 electron = số proton
⇒ Nguyên tố đó là Nitrogen (kí hiệu: N)
Cho các nguyên tử được kí hiệu bởi các chữ cái và số proton trong mỗi nguyên tử như sau:
| Nguyên tử | X | Y | Z | R | E | Q |
| Số proton | 6 | 8 | 17 | 6 | 9 | 18 |
Các nguyên tử thuộc cùng một nguyên tố hóa học là
Các nguyên tử thuộc cùng một nguyên tố hóa học khi các nguyên tử có cùng số proton trong hạt nhân.
Quan sát bảng, ta thấy có nguyên tử X và R đều có cùng số proton là 6
⇒ Nguyên tử X và R thuộc cùng 1 nguyên tố hóa học
Kí hiệu hóa học của nguyên tố Calcium là
Đối với nguyên tố kí hiệu bằng 2 chữ cái thì chữ cái đầu viết in hoa, chữ cái thứ 2 viết thường
⇒ Nguyên tố chlorine có kí hiệu hóa học là Cl
Tổng số hạt cơ bản trong nguyên tử X là 36. Trong đó tổng số hạt mang điệ nhiều hơn số hạt không mang điện là 12 hạt. X có kí hiệu hoá học là:
Ta có tổng số hạt = Số p + số e + số n = 36 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 12
⇒ Số p + số e - số n = 12 (2)
Nguyên tử trung hoà về điện nên tổng số hạt proton bằng tổng số hạt electron
⇒ Số e = số p
Từ (1), (2) và (3) suy ra: số p = số e = 12
Số n = 12
⇒ X là Mg
Tổng số hạt proton, neutron, electron trong hai nguyên tử của nguyên tố X và Y là 118 trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 38. Số hạt mang điện của nguyên tử Y nhiều hơn của X là 2. X và Y lần lượt là:
Tổng số hạt trong X và Y = (Số p + Số e + Số n) trong X và Y = 118 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 38 hạt
(số p + số e - số n) trong X và Y = 38 (2)
Nguyên tử trung hoà về điện nên tổng số hạt proton bằng tổng số hạt electron
(Số p)trong X và Y = (Số e) trong X và Y =
Mà số hạt mang điện của nguyên tử Y nhiều hơn của X là 2
(Số p + số e) trong Y - (Số p + số e) trong X = 2
(2.số p) trong Y - (2.số p)trong X = 2
(Số p) trong Y - (số p) trong X = 1 (4)
Từ (3) và (4) suy ra (Số p) trong Y = 20; (số p) trong X = 19
Vậy X là K, Y là Ca
Nguyên tố hóa học nào dưới đây được kí hiệu bằng 2 chữ cái
Calcium: Ca
Nitrogen: N
Oxygen: O
Phosphorus: P
Tổng số các loại hạt trong nguyên tử M là 21. Nguyên tử M có tổng số hạt mang điện gấp đôi số hạt không mang điện. M là
Gọi số hạt proton, electron, neutron lần lượt là p, e, n ta có theo đề bài
Tổng số hạt của nguyên tử M là:
p + e + n = 21 (1)
Số hạt mang điện gấp đôi số hạt không mang điện
e + p = 2n (2)
Nguyên tử trung hoà về điện do đó
p = e (3)
Từ (1), (2) và 2 ta được 3p = 21
⇒ p = 7
Vậy nguyên tử M là N
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
