Nồng độ mol/lít của dung dịch là
Nồng độ mol của dung dịch
Nồng độ mol/lít của dung dịch là được VnDoc biên soạn hướng dẫn bạn đọc trả lời câu hỏi liên quan đến khái niệm nồng độ mol/ lít. Ngoài ra tài liệu còn đưa ra các nội dung lý thuyết, câu hỏi vận dụng liên. Hy vọng sẽ giúp ích cho bạn đọc trong quá trình học tập củng cố nội dung kiến thức trong quá trình học tập. Mời các bạn tham khảo chi tiết nội dung dưới đây.
Nồng độ mol/lít của dung dịch là
Nồng độ mol/lít của dung dịch là gì?
A. Số gam chất tan trong 1 lít dung dịch
B. Số gam chất tan trong 1 lít dung môi
C. Số mol chất tan trong 1 lít dung dịch
D. Số mol chất tan trong 1 lít dung môi
Đáp án hướng dẫn giải chi tiết
Nồng độ mol/lít của dung dịch là số mol chất tan trong 1lít dung dịch
Đáp án C
Công thức tính nồng độ mol
Nồng độ mol của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch
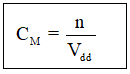
Trong đó: CM là nồng độ mol
n là số mol chất tan
Vdd là thể tích dung dịch (lít)
Thí dụ : Tính nồng độ mol của dung dịch khi 0,4 lit dung dịch CuSO4 chứa 150 gam CuSO4
Hướng dẫn giải
Số mol của CuSO4 = 150 : 160 = 0,9375 mol
Nồng độ mol của dung dịch CuSO4 = 0,9375 : 0,4 = 0,375M
Câu hỏi vận dụng liên quan
Câu 1. Cho các công thức sau, công thức liên hệ giữa nồng độ mol( CM) và nồng độ phần trăm (C%) của chất tan có phân tử khối M nào dưới đây đúng:
A. ![]() \(C_{M\hspace{0.278em}}=\frac{10.M.C\%}D\)
\(C_{M\hspace{0.278em}}=\frac{10.M.C\%}D\)
B. ![]() \(C_{M\;}=\frac{10.D.C\%}M\)
\(C_{M\;}=\frac{10.D.C\%}M\)
C. ![]() \(C_M=\frac{10.M.D}{C\%}\)
\(C_M=\frac{10.M.D}{C\%}\)
D. ![]() \(C_M=\frac{M.C\%}{10.D}\)
\(C_M=\frac{M.C\%}{10.D}\)
Đáp án B
Hướng dẫn giải chi tiết
Lấy V lít hay 1000V ml dung dịch
Khối lượng dung dịch là: mdd = 100.V. D
Khối lượng chất tan là:
![]() \(\frac{m_{dd}}{100\%}.C\%=\frac{100.D.V}{100\%}.C\%=10V.D.C\%\)
\(\frac{m_{dd}}{100\%}.C\%=\frac{100.D.V}{100\%}.C\%=10V.D.C\%\)
Số mol của chất tan là:
![]() \(n_{C\tan}=\frac{m_{c\tan}}M=\frac{10.V.D.C\%}M\)
\(n_{C\tan}=\frac{m_{c\tan}}M=\frac{10.V.D.C\%}M\)
Ta có:
 \(\begin{array}{l}C_M=\frac{n_{c\tan}}V=\frac{\displaystyle\frac{10V.D.C\%}M}V\\\end{array}\)
\(\begin{array}{l}C_M=\frac{n_{c\tan}}V=\frac{\displaystyle\frac{10V.D.C\%}M}V\\\end{array}\)
Vậy công thức giữa nồng độ mol( CM) và nồng độ phần trăm (C%) của chất tan có phân tử khối M là
![]() \(C_{M\hspace{0.278em}}=\frac{10.D.C\%}M\)
\(C_{M\hspace{0.278em}}=\frac{10.D.C\%}M\)
Câu 2. Trộn 1 lít dung dịch đường 0,5M với 1,5 lit dung dịch đường 1M. Nồng độ mol của dung dịch đường sau khi trộn là
A. 0,8 M
B. 0,4 M
C. 1,6 M
D. 0,2 M
Đáp án A
Đáp án hướng dẫn giải chi tiết
Tính số mol đường có trong dung dịch 1:
n1 = CM 1.Vdd 1 = 0,5.1 = 0,5 mol
Tính số mol đường có trong dung dịch 2:
n2 = CM2.Vdd 2 = 1.1,5 = 1,5 mol
Tính số mol đường có trong dung dịch 3:
n3 = n1 + n2 = 0,5 + 1,5 = 2 mol
Tính thể tích dung dịch 3
Vdd 3 = Vdd 1 + Vdd 2 = 1 + 1,5 = 2,5 lit
Tính nồng độ mol dung dịch 3
CM = n : V = 2: 2,5 = 0,8 M
Câu 3. Câu nào sau đây đúng khi nói về nồng độ mol của dung dịch
A. Số gam chất tan có trong 100g dung dịch
B. Số mol chất tan có trong 100g dung dịch bão hòa.
C. Số mol chất tan có trong 1 lít dung dịch
D. Số gam chất tan có trong 1 lít dung dịch.
Đáp án C
Câu 4. Để tính nồng độ mol của dung dịch HCl người ta làm thế nào?
A. Tính số gam HCl có trong 100 gam dung dịch.
B. Tính số gam HCl có trong 1 lít dung dịch.
C. Tính số gam HCl có trong 1000 gam dung dịch.
D. Tính số mol HCl có trong 1 lít dung dịch.
Đáp án D
Câu 5. Trong phòng thí nghiệm một bình đựng dung dịch axit H2SO4 trên nhãn mác có ghi “ dung dịch H2SO4 2M”. Nội dung đó có ý nghĩa gì:
A. Có 2 mol H2SO4 trong 1 lít dung dịch.
B. Có 2 gam H2SO4 trong 1 lít dung dịch.
C. Có 2 mol H2SO4 trong 100 gam dung dịch.
D. Có 2 gam H2SO4 trong 100 gam dung dịch.
Đáp án C
................................................
Trên đây VnDoc đã đưa tới các bạn một tài liệu rất hữu ích Nồng độ mol/lít của dung dịch là. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lí 8, Lý thuyết Sinh học 8, Giải bài tập Hóa học 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.



