Bản tường trình bài thực hành số 5 hóa 10
Bài thực hành số 5 hóa học 10
Bài thực hành số 5 hóa 10 được VnDoc biên soạn là nội dung bài 35 sách giáo khoa hóa 10 trang 148. Nội dung tài liệu giúp các bạn học sinh. soạn bài cũng như chuẩn bị bài thực hành số 5: Tính chất các hợp chất của lưu huỳnh một cách tốt nhất.
Mời các bạn tham khảo một số bản tường trình bài thực hành hóa học 10 có trong chương trình:
Họ và tên: ...............................................................................
Lớp :................................................................................
A. Báo cáo bài thực hành số 5 Hóa 10
1. Thí nghiệm 1: Điều chế - chứng minh tính khử của hidro sunfua
Dụng cụ, hóa chất:
Dụng cụ: ống nghiệm, nút cao su, ống vuốt nhọn ngắn, giá đỡ, que đóm, đèn cồn,...
Hóa chất: dung dịch HCl, FeS.
Cách tiến hành:
Lắp dụng cụ điều chế khí H2S như hình vẽ
Cho dung dịch HCl khoảng 1/3 ống nghiệm, sau đó thêm FeS, đậy nút cao su.
Chờ khoảng 15 – 30s đốt khí thoát ra từ ống vuốt nhọn.
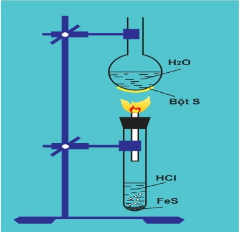
Hiện tượng:
H2S thoát ra có mùi trứng thối.
H2S cháy trong không khí ngọn lửa màu xanh.
Phương trình hóa học
2HCl + FeS → FeCl2 + H2S
2H2S + O2 → 2S + 2H2O
=> H2S đóng vài trò là chất khử, O2 đóng vai trò là chất oxi hóa.
2. Thí nghiệm 2: Tính khử của lưu huỳnh đioxit
Dụng cụ, hóa chất:
Dụng cụ: ống nghiệm, kẹp gỗ, ống dẫn khí, giá đỡ,...
Hóa chất: dung dịch H2SO4, Na2SO3, dung dịch Br2.
Cách tiến hành:
Dẫn khí lưu huỳnh đioxit vào dung dịch brom.
Hiện tượng:
Dung dịch nước brom nhạt màu dần rồi mất màu:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑
SO2 + Br2 + 2H2O→ 2HBr + H2SO4
SO2 đóng vai trò là chất khử, Br2 đóng vai trò là chất oxi hóa.
3. Thí nghiệm 3: Tính oxi hóa của lưu huỳnh đioxit
Dụng cụ, hóa chất:
Dụng cụ: dụng cụ điều chế H2S như ở thí nghiệm 1, ống dẫn khí,...
Hóa chất: dung dịch H2S, khí SO2.
Cách tiến hành:
Dẫn khí H2S điều chế ở trên vào nước, được dung dịch axit sunfuhidric.
Dẫn khí SO2 vào dung dịch H2S.
Hiện tượng:
Khi sục từ từ khí SO2 vào dung dịch H2S ta thấy có vẩn đục màu vàng
SO2 + 2H2S → 3S↓ + 2H2O
=> Trong phản ứng trên, SO2 đóng vai trò là chất oxi hóa, H2S đóng vai trò là chất khử.
4. Thí nghiệm 4: Tính oxi hóa của axit sunfuric đặc
Quan sát hiện tượng, viết phương trình hóa học.
Xác định vai trò các chất tham gia phản ứng.
Dụng cụ, hóa chất:
Dụng cụ: ống nghiệm, kẹp gỗ, bông, đèn cồn...
Hóa chất: dung dịch H2SO4 đặc, lá đống nhỏ, kiềm (hoặc dung dịch KMnO4)
Cách tiến hành:
Nhỏ vài giọt axit sunfuric đặc vào ống nghiệm.
Cho một vài lá đồng nhỏ vào ống nghiệm, đun nóng nhẹ, miệng ống nghiệm được nút bằng bông tẩm kiềm hoặc KMnO4
Hiện tượng:
Dung dịch có bọt khí và từ không màu chuyển sang màu xanh.
Cu + 2H2SO4(đ) ![]() \(\overset{t^{\circ } }{\rightarrow}\) CuSO4 + SO2 + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) CuSO4 + SO2 + 2H2O
=> Đồng là chất khử H2SO4 đặc là chất oxi hóa
B. Một số lưu ý trong quá trình thực hành và viết bản tường trình bài thực hành số 5 Hóa 10
Trên đây VnDoc đã gửi tới bạn đọc chi tiết nội dung Hóa 10 bài thực hành số 5 tính chất các hợp chất của lưu huỳnh gồm có 4 thí nghiệm:
- Thí nghiệm 1: Điều chế - chứng minh tính khử của hidro sunfua
- Thí nghiệm 2: Tính khử của lưu huỳnh đioxit
- Thí nghiệm 3: Tính oxi hóa của lưu huỳnh đioxit
- Thí nghiệm 4: Tính oxi hóa của axit sunfuric đặc
Để có thể hoàn thành tốt bài thực hành thí nghiệm trên lớp một cách tốt nhất, cũng như biết cách viết báo cáo sau khi thực hành một cách chính xác bạn đọc cần:
Nắm được các nội quy của phòng thí nghiệm, cũng như cách sử dụng, dụng cụ thí nghiệm hóa chất, tránh gây đổ vỡ, mất an toàn. Tuyệt đối tuân theo sự hướng dẫn của giáo viên bộ môn.
-----------------------------
Trên đây VnDoc đã giới thiệu Bản tường trình bài thực hành số 5 hóa 10. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook, mời bạn đọc tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.



