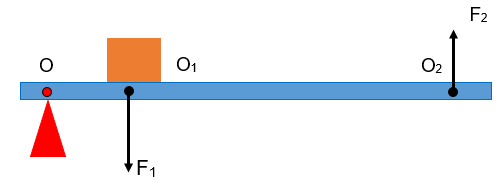Xác định kim loại
Hòa tan hoàn toàn 7 gam một kim loại R hóa trị II cần vừa đủ 96 gam dung dịch HCl 9,5%. Xác định tên kim loại R.
Khối lượng HCl trong 96 gam dung dịch HCl 9,5% là:
Số mol HCl bằng:
Phương trình phản ứng hóa học
R + HCl → RCl2 + H2
0,125 ← 0,25 (mol)
Khối lượng mol kim loại R bằng:
MR = mR : nR = 7 : 0,125 = 56 gam/mol
Kim loại R là Fe