Muối
1. Khái niệm
Phản ứng tạo thành muối, tên gọi và thành phần phân tử của một số muối
|
Phản ứng |
Công thức phân tử của muối tạo thành và tên gọi |
Thành phần phân tử của muối tạo thành |
|
|
Cation kim loại |
Anion gốc acid |
||
|
Kim loại + Acid → Muối + Hydrogen Zn + 2HCl → ZnCl2 + H2 |
ZnCl2 Zinc chloride |
Zn2+ |
Cl− |
|
Acid + Base → Muối + Nước H2SO4 + Cu(OH)2 → CuSO4 + 2H2O |
CuSO4 Copper(II) sulfate |
Cu2+ |
SO42− |
|
Acid + Oxide base → Muối + Nước H2SO4 + FeO → FeSO4 + H2O |
FeSO4 Iron(II) sulfate |
Fe2+ |
SO42− |
Muối là hợp chất, được tạo thành từ sự thay thế ion H+ của acid bằng ion kim loại hoặc ion ammonium (NH4+).
Ví dụ:
Na2SO4 (sodium sulfate);
NH4Cl (ammonium chloride).
2. Cách gọi tên muối
Công thức phân tử của muối gồm có cation kim loại và anion gốc acid được gọi tên theo quy tắc sau:
Tên kim loại (hoá trị, đối với kim loại có nhiều hoá trị) + tên gốc acid
Tên gọi của một số gốc acid được thể hiện trong bảng sau:
|
Gốc acid |
Tên gọi |
Gốc acid |
Tên gọi |
|
− Cl |
chloride |
− CH3COO |
acetate |
|
− Br |
bromide |
= S |
sulfide |
|
− I |
iodide |
− HS |
hydrogensulfide |
|
− NO3 |
nitrate |
= CO3 |
carbonate |
|
= SO4 |
sulfate |
− HCO3 |
hydrogencarbonate |
|
− HSO4 |
hydrogensulfate |
≡ PO4 |
phosphate |
|
= SO3 |
sulfide |
= HPO4 |
hydrogenphosphate |
3. Tính tan của muối
Đa số các muối là chất rắn, có những muối không tan trong nước, có muối ít tan, có muối tan tốt trong nước. Người ta đã xây dựng bảng tính tan của các chất để tiện sử dụng.
Bảng tính tan trong nước của một số muối
|
Gốc acid |
Các kim loại |
|||||||||||
|
K I |
Na I |
Ag I |
Mg II |
Ca II |
Ba II |
Zn II |
Pb II |
Cu II |
Fe II |
Fe III |
Al III |
|
|
− Cl |
t |
t |
k |
t |
t |
t |
t |
i |
t |
t |
t |
t |
|
− NO3 |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
|
= SO4 |
t |
t |
i |
t |
i |
k |
t |
k |
t |
t |
t |
t |
|
= CO3 |
t |
t |
k |
k |
k |
k |
k |
k |
- |
k |
- |
- |
|
≡ PO4 |
t |
t |
k |
k |
k |
k |
k |
k |
k |
k |
k |
k |
Trong đó:
- t: chất dễ tan trong nước
- k: chất không tan (độ tan nhỏ hơn 0,01 g/100 g nước).
- i: chất ít tan (độ tan nhỏ hơn 1 g/100 g nước).
- (-): chất không tồn tại hoặc bị nước phân huỷ.
II. Tính chất hoá học
Một số tính chất chung của muối
1. Dung dịch muối tác dụng với kim loại
Dung dịch muối có thể tác dụng với một số kim loại tạo thành muối mới và kim loại mới.
Ví dụ:
Zn + FeSO4 → ZnSO4 + Fe.
2. Muối tác dụng với dung dịch acid
Muối có thể tác dụng với một số dung dịch acid tạo thành muối mới và acid mới. Sản phẩm của phản ứng tạo thành có ít nhất một chất là chất khí/ chất ít tan/ không tan, …
Ví dụ:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
3. Dung dịch muối tác dụng với dung dịch base
Dung dịch muối tác dụng với dung dịch base tạo thành muối mới và base mới, trong đó có ít nhất một sản phẩm là chất khí/ chất ít tan/ chất không tan,…
Ví dụ:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4.
4. Dung dịch muối tác dụng với dung dịch muối
Hai dung dịch muối tác dụng với nhau tạo thành hai muối mới, trong đó ít nhất có một muối không tan hoặc ít tan.
Ví dụ:
2AgNO3 + BaCl2 → 2AgCl + Ba(NO3)2.
Phản ứng trao đổi:
Các phản ứng trong dung dịch giữa muối với acid, base, muối thuộc loại phản ứng trao đổi, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
Điều kiện để phản ứng trao đổi trong dung dịch xảy ra là sản phẩm tạo thành ít nhất một chất không tan/ chất khí, …
III. Điều chế
Muối có thể điều chế bằng một số phương pháp như sau:
1. Dung dịch acid tác dụng với base.
Ví dụ:
HCl + NaOH → NaCl + H2O.
2. Dung dịch acid tác dụng với oxide base.
Ví dụ:
2HNO3 + CuO → Cu(NO3)2 + H2O.
3. Dung dịch acid tác dụng với muối.
Ví dụ:
H2SO4 + BaCl2 → BaSO4 + 2HCl.
4. Oxide acid tác dụng với dung dịch base.
Ví dụ:
CO2 + 2NaOH → Na2CO3 + H2O.
5. Dung dịch muối tác dụng với dung dịch muối.
Ví dụ:
NaCl + AgNO3 → AgCl + NaNO3.
IV. Mối quan hệ giữa các hợp chất vô cơ
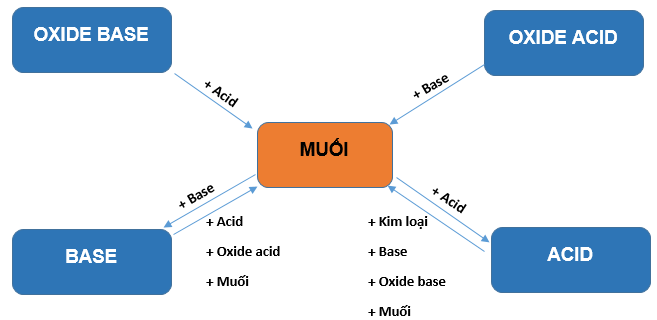
Phương trình phản ứng minh họa
1. Tính chất của oxide
+ Oxide base tác dụng với acid tạo thành muối và nước.
Ví dụ:
CaO + 2HCl → CaCl2 + H2O.
+ Oxide acid tác dụng với dung dịch base tạo thành muối và nước.
Ví dụ:
SO2 + 2NaOH → Na2SO3 + H2O.
2. Tính chất của acid
+ Tác dụng với kim loại tạo thành muối và khí.
Ví dụ:
Fe + 2HCl → FeCl2 + H2.
+ Tác dụng với base tạo thành muối và nước.
Ví dụ:
HCl + NaOH → NaCl + H2O.
+ Tác dụng với oxide base tạo thành muối và nước.
Ví dụ:
H2SO4 + Na2O → Na2SO4 + H2O.
+ Tác dụng với muối tạo thành muối mới và acid mới.
Ví dụ:
H2SO4 + BaCl2 → BaSO4 + 2HCl.
3. Tính chất của base
+ Tác dụng với acid tạo thành muối và nước.
Ví dụ:
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O.
+ Tác dụng với oxide acid tạo thành muối và nước.
Ví dụ:
Ca(OH)2 + CO2 → CaCO3 + H2O.
+ Tác dụng với dung dịch muối tạo thành muối mới và base mới.
Ví dụ:
Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH.







