Đề thi học kì 1 môn Hóa học lớp 11 trường THPT Đoàn Thượng, Hải Dương năm học 2016 - 2017
Đề thi học kì 1 môn Hóa học lớp 11
Đề thi học kì 1 môn Hóa học lớp 11 trường THPT Đoàn Thượng, Hải Dương năm học 2016 - 2017 là đề thi học kì I môn Hóa lớp 11 có đáp án. Tài liệu này giúp các em tự luyện tập và kiểm tra kiến thức nhằm đạt kết quả tốt trong bài thi cuối học kì I. Chúc các em học tốt.
Đề thi học kì 1 môn Vật lý lớp 11 trường THPT Đoàn Thượng, Hải Dương năm học 2016 - 2017
Đề thi học kì 1 môn Sinh học lớp 11 trường THPT Đoàn Thượng, Hải Dương năm học 2016 - 2017
|
SỞ GIÁO DỤC VÀ ĐÀO TẠO HẢI DƯƠNG TRƯỜNG THPT ĐOÀN THƯỢNG
|
ĐỀ KIỂM TRA HỌC KỲ I NĂM HỌC 2016 - 2017 MÔN: HÓA HỌC – Lớp 11 Thời gian làm bài: 45 phút. |
Câu 1 (3,0 điểm) Viết các phương trình phản ứng xảy ra (ghi rõ điều kiện nếu có):
| a/ P + Cl2 (thiếu) | d/ Al + C |
| b/ N2 + O2 | e/ Sục khí CO2 vào dd Na2SiO3 |
| c/ FeO + HNO3 loãng, giải phóng khí NO2 | f/ NaHCO3 + HCl |
Câu 2 (3,0 điểm)
- Trộn 200 ml dung dịch NaOH 0,5M với 300 ml dung dịch H2SO4 0,05M thu được 500 ml dung dịch A. Xác định pH của A.
- Dẫn luồng khí CO dư đi từ từ qua hỗn hợp B gồm: CuO và Al2O3, nung nóng đến phản ứng hoàn toàn thu được hỗn hợp khí X và chất rắn Y. Cho X lội từ từ qua nước vôi trong dư. Xác định các chất trong X, Y và viết các PTPƯ xảy ra.
- Viết phương trình phản ứng điều chế:
- H3PO4 từ P2O5
- NH3 trong công nghiệp từ N2.
Câu 3 (2,0 điểm)
- Cho m gam hỗn hợp G gồm: Fe và CuO tác dụng với dung dịch HNO3 loãng, dư thu được 0,336 lít khí NO (sản phẩm khử duy nhất, đktc) và dung dich E chứa 5,51 gam hỗn hợp muối. Tính giá trị m và số mol axit đã phản ứng.
- Cho từ từ khí CO qua ống sứ đựng 5,36 gam CuO, t0. Khí ra khỏi ống được hấp thụ từ từ vào nước vôi trong dư thu được 4,5gam kết tủa. Chất rắn còn lại trong ống sứ cho vào cốc đựng 84ml dung dịch HNO3 1M thu được V1 lít NO. Thêm tiếp vào cốc 210ml dung dịch H2SO4 1M, sau phản ứng thu thêm V2 lít NO. Cho tiếp x gam Zn vào cốc, pứ xong thu được khí A (N2 là sản phẩm khử duy nhất của N+5), dung dịch B và hỗn hợp các kim loại C. Tính V1, V2 và x. Biết các pứ xảy ra hoàn toàn và các khí đo ở đktc.
Câu 4 (2,0 điểm)
- Đốt cháy hoàn toàn 3,7 gam một hợp chất hữu cơ X. Dẫn toàn bộ sản phẩm cháy (chỉ gồm CO2 và H2O) lần lượt qua bình (1) chứa H2SO4 đặc, bình (2) chứa dung dịch NaOH dư (mắc nối tiếp với bình 1). Kết thúc thí nghiệm thấy khối lượng bình (1) tăng 4,5 gam và bình (2) tăng 8,8 gam. Biết tỉ khối hơi của X so với khí He bằng 18,5. Xác định công thức phân tử của X.
- Viết CTCT thu gọn của các chất no, mạch hở có CTPT C4H8O.
- Viết công thức chung cho dãy đồng đẳng của CH3COOH.
Cho nguyên tử khối các nguyên tố: Mg = 24; Fe = 56; Cu = 64; C = 12; H = 1; O = 16; S = 32; N = 14; Ca = 40; Na = 23; Al = 27; Zn = 65
Đáp án đề thi học kì 1 môn Hóa học lớp 11
Câu 1 (3,0 điểm)
Mỗi PTHH viết đúng
Nếu không cân bằng hoặc không ghi điều kiện pư (nếu có) trừ 0,125đ/1pt
Câu 2 (3,0 điểm)
1. Tính được số mol OH- = 0,1 (mol), số mol H+ = 0,03 mol
H+ + OH- → H2O
0,03 0,1 mol
nOH- (dư) = 0,1 – 0,03 = 0,07 (mol)
[OH-]dư = 0,07/0,5 = 0,14 M
Vậy pOH = 0,85 → pH = 13,15
2. CuO + CO → Cu + CO2 (đk: to)
Chất rắn Y gồm: Cu và Al2O3.
Hỗn hợp khí X gồm: CO dư và CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
3. PTHH:
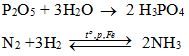
Câu 3 (2,0 điểm)
1. Viết đúng 2 ptr:
Fe + 4HNO3 → Fe(NO3)3 + NO + H2O
x 4x x x
CuO + 2HNO3 → Cu(NO3)2 + H2O
y 2y y
Theo pư: x = số mol NO = 0,015 mol.
242 x + 188y = 5,51 => y = 0,01.
m = 0,015.56 + 0,01.80 = 1,64 gam
Số mol HNO3 = 4x + 2y = 0,08.
2. Pư:
CO + CuO Cu + CO2 (t0) (1)
0,045 <-- 0,045 <-- 0,045 mol
CO2 + Ca(OH)2dư → CaCO3 + H2O (2)
0,045 <-- 0,045 mol
Tính được: nCuO = 0,067 mol; nCO2 = 0,045 mol
Sau phản ứng có 0,045 mol Cu tạo thành và 0,022 mol CuO dư
Cho chất rắn vào HNO3; nHNO3 = 0,084 mol
CuO + 2HNO3 Cu(NO3)2 + H2O (3)
0,022 0,044 0,022 mol
3Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O (4)
0,015 <-- 0,04 0,015 0,01 mol
=> V1 = VNO (4) = 0,224 lít và nCudư = 0,03 mol
Cho H2SO4:
3Cudư + 8H+ + 2NO3− 3Cu2+ + 2NO + 4H2O (5)
0,03 ---> 0,08 -- > 0,02 0,03 0,02 mol
nH+ = 0,42 mol ; nNO3- = 0,074 mol. So sánh tỉ lệ mol của Cudư, H+ và NO3- sau pư (5): vẫn còn dư.
Tính đúng => x = 0,245 x 65 = 15,925 (g)
Câu 4 (2,0 điểm)
Khối lượng H2O = mbình (1) tăng = 4,5 gam
Khối lượng CO2 = mbình (2) tăng = 8,8 gam
mH = 0,5 gam; mC = 2,4 gam => mO = 3,7 - 0,5 - 2,4 = 0,8 gam.
Gọi CT X là CxHyOz
Ta có x : y : z = 0,2 : 0,5 : 0,05 = 4 : 10 : 1
CTĐGN: C4H10O
MX = 18,5.4 = 74 (gam/mol).
Gọi CTPT X là (C4H10O)n => 74n = 74 => n = 1.
Vậy CTPT là C4H10O
Viết được đúng 03 CT: 2 andehit, 1 xeton.
C2H4O2 → Ta thấy số liên kết pi trong phân tử trên = 1
Đặt công thức chung là CnHmO2
Ta có: a = (2n + 2 – m)/2 = 1 => m = 2n
Vậy công thức chung của dãy đồng đẳng là CnH2n O2 (n ≥ 1)



