Đề thi học sinh giỏi cấp huyện môn Hóa học lớp 9 huyện Thạch Hà năm 2014 - 2015
Đề thi học sinh giỏi cấp huyện môn Hóa học lớp 9
Đề thi học sinh giỏi cấp huyện môn Hóa học lớp 9 năm học 2015 - 2016 phòng GD&ĐT huyện Thạch Hà là đề tham khảo dành cho các bạn học sinh và thầy cô nghiên cứu, học tập tốt môn Hóa lớp 9 cũng như luyện tập và làm quen với nhiều đề học sinh giỏi hơn nhằm chuẩn bị tốt nhất cho các kì thi sắp diễn ra. Mời các bạn tham khảo.
Đề thi học sinh giỏi môn Địa lý lớp 9 trường THCS Hạ Hòa, Phú Thọ năm 2015 - 2016
Đề thi học sinh giỏi môn Sinh học lớp 9 trường THCS Hạ Hòa, Phú Thọ năm 2015 - 2016
|
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO HUYỆN THẠCH HÀ |
ĐỀ THI CHỌN HỌC SINH GIỎI CẤP HUYỆN NĂM HỌC 2014 - 2015 MÔN THI: HÓA HỌC- LỚP 9 THCS Thời gian làm bài: 150 phút (Không kể thời gian giao đề) |
Câu 1. (1,5 điểm): Viết phương trình hóa học cho dãy chuyển hóa sau (ghi rõ điều kiện phản ứng, nếu có)
CuS→ CuO → CuCl2→ Cu(OH)2→ CuO→ Cu→ CuSO4
Câu 2 (2 điểm): Viết phương trình phản ứng trong đó 0,75 mol H2SO4 tham gia phản ứng sinh ra:
a/ 8,4 lít SO2 (đktc). b/ 16,8 lít SO2 (đktc).
c/ 25,2 lít SO2 (đktc). d/ 33,6 lít SO2 (đktc).
Câu 3 (2 điểm): Cho các hóa chất CaCO3, NaCl, H2O và các dụng cụ cần thiết để làm thí nghiệm, trình bày phương pháp để điều chế dung dịch gồm 2 muối Na2CO3 và NaHCO3 có tỉ lệ số mol là 1:1.
Câu 4 (2 điểm): Có 4 dung dịch đựng trong 4 lọ không nhãn gồm: KCl, Na2CO3, H2SO4, BaCl2. Không dùng thêm hóa chất nào hết hãy phân biệt 4 dung dịch trên bằng phương pháp hóa học.
Câu 5 (2,5 điểm): Trong cốc chứa bột Mg, lần lượt thêm vào cốc các chất theo thứ tự sau (lần thêm sau phải đợi cho phản ứng ở lần thêm trước kết thúc): H2SO4dư, NaOHdư, HCl dư, BaCl2dư. Cuối cùng thêm Na2CO3 vừa đủ (không tạo muối NaHCO3) thu được dung dịch Y. Viết các phương trình hóa học xảy ra, cho biết trong dung dịch Y tồn tại những chất tan nào?
Câu 6 (3,5 điểm): Hỗn hợp X gồm Fe, FeO, Fe3O4, Fe2O3 có số mol bằng nhau. Lấy 52 gam hỗn hợp X cho vào dung dịch HCl dư thu được dung dịch A. Cho dung dịch NaOH đến dư vào dung dịch A thu được kết tủa B. Lọc lấy kết tủa B nung ngoài không khí đến khối lượng không đổi được m gam chất rắn C. Tìm giá trị của m. Biết các phản ứng xảy ra hoàn toàn.
Câu 7 (3 điểm): Cho 3,87 gam hỗn hợp A gồm Mg và Al vào 250 ml dung dịch chứa 2 axit HCl 1M và H2SO4 0,5M được dung dịch B và 4,368 lít H2 (đktc).
Chứng minh dung dịch B vẫn còn dư axit (biết các phản ứng xẩy ra hoàn toàn).
Tính% khối lượng mỗi kim loại trong hỗn hợp A.
Câu 8 (2 điểm): Trên hai đĩa cân đặt hai cốc dung dịch HCl và H2SO4 loãng có khối lượng bằng nhau, cân thăng bằng.
Cho vào cốc đựng dung dịch HCl 25gam CaCO3.
Cho vào cốc đựng dung dịch H2SO4 (a) gam Al.
Sau khi phản ứng kết thúc, cân vẫn giữ vị trí thăng bằng. Hãy viết phương trình phản ứng và tính (a), biết các phản ứng xảy ra hoàn toàn.
Câu 9 (1,5 điểm): Khi hoà tan một lượng oxit kim loại hoá trị II vào một lượng vừa đủ dung dịch axit H2SO4 4,9%, người ta thu được một dung dịch muối có nồng độ 5,78%. Xác định công thức của oxit trên.
Đáp án đề thi học sinh giỏi cấp huyện môn Hóa học lớp 9
Câu 1:
2CuS + 3O2→ 2CuO + 2SO2
CuO +2 HCl →CuCl2 + H2O
CuCl2 +2 NaOH →Cu(OH)2 + 2NaCl
Cu(OH)2→ CuO + H2O
CuO +H2 →Cu + H2O
Cu + 2H2SO4 (đ) →CuSO4+ SO2 + 2H2O
Câu 2:
a) nSO2/nH2SO4 = 0,375/0,75 = 1/2 => Cu + 2H2SO4 đặc → CuSO4 + SO2 ↑+ 2H2O
b) nSO2/nH2SO4 = 0,75/0,75 = 1 => Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
c) nSO2/nH2SO4 = 1,125/ 0,75 = 3/2 => S + 2H2SO4 đặc → 3SO2 ↑ + 2H2O
d) nSO2/ nH2SO4 = 1,5/0,75 = 2 => 2NaHSO3 + H2SO4 → Na2SO4 + 2SO2 ↑ + H2O
Chú ý: Học sinh chọn chất khác và viết phương trình hóa học đúng, cho điểm tối đa tương ứng.
Câu 3:
Tạo ra và thu lấy khí CO2: Nhiệt phân CaCO3
CaCO3 →CaO + CO2 ↑
Tạo ra dung dịch NaOH: Điện phân dd NaCl bão hòa có màng ngăn
2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑
Viết các phương trình tạo muối
CO2(dư) + NaOH → NaHCO3 (1)
2a → 2a (mol)
NaHCO3 + NaOH → Na2CO3 + H2O (2)
a ← a → a (mol)
Trình bày cách tiến hành thí nghiệm: lấy 2 thể tích dung dịch NaOH cho vào cốc A và cốc B sao cho VA = 2VB (dùng cốc chia độ)
Gọi số mol NaOH ở cốc A là 2a mol thì số mol NaOH ở cốc B là a mol
Sục CO2 dư vào cốc A, xảy ra phản ứng (1)
Sau đó đỏ cốc A vào cốc B: xảy ra phương trình (2)
Kết quả thu được dung dịch có số mol NaHCO3 là a mol và số mol Na2CO3 là a mol => tỉ lệ 1:1
Câu 4:
Lấy ở mỗi dung dịch ra1 ít làm thuốc thử, cho các chất tác dụng lần lượt với nhau từng đôi một. Kết quả:
| BaCl2 | Na2CO3 | H2SO4 | KCl | |
| BaCl2 | - | BaCO3↓ | BaSO4↓ | - |
| Na2CO3 | BaCO3↓ | - | CO2↑ | - |
| H2SO4 | BaSO4↓ | CO2↑ | - | - |
| KCl | - | - | - | - |
Dung dịch không có hiện tượng gì là dung dịch KCl
Dung dịch tạo 2 kết tủa trắng với 2 dung dịch khác là BaCl2
BaCl2 + Na2CO3→ BaCO3↓ + 2NaCl
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
2 dung dịch tạo 1 chất khí và 1 kết tủa trắng với 2 dung dịch khác là H2SO4 và Na2CO3.
Lấy 2 mẫu thử chưa phân biệt được là Na2CO3 và H2SO4. Sau đó cho 2 mẩu vào 2 kết tủa ở trên. Nếu mẫu nào phản ứng với 1 trong 2 kết tủa trắng làm xuất hiện kết tủa trắng mới và có khí thoát ra thì mẫu đó là H2SO4 , mẫu còn lại là Na2CO3
H2SO4 + BaCO3 → BaSO4 + CO2↑ + H2O
Câu: 5
Mg + H2SO4 →MgSO4 + H2 ↑
H2SO4 + 2NaOH → Na2SO4 + 2H2O
2NaOH + MgSO4 →Na2SO4 +Mg(OH)2
HCl + 2NaOH → NaCl + 2H2O
2HCl + Mg(OH)2 →MgCl2 + 2H2O
BaCl2 + Na2SO4 →BaSO4↓ + 2NaCl
Na2CO3 + HCl →NaCl + CO2 ↑ + H2O
BaCl2 + Na2CO3 →BaCO3 ↓+ 2NaCl
Na2CO3 + MgCl2 →NaCl + MgCO3 ↓
Trong dung dịch Y chỉ có duy nhất NaCl
Câu 6
Gọi số mol mỗi chất trong hỗn hợp X là a. Ta có:
56a + 72 a + 232 a + 160 a = 52
a = 0,1 ( mol)
PTHH:
Fe + 2HCl → FeCl2 + H2 (1)
0,1 0,1
FeO + 2HCl→ FeCl2 + H2O (2)
0,1 0,1
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 +4H2O (3)
0,1 0,1 0,2
Fe2O3 + 6HCl →2FeCl3 +3H2O (4)
0,1 0,2
Từ (1), (2), (3)
nFeCl2= 0,1 + 0, 1 + 0,1 = 0,3 (mol)
Từ (3), (4)
nFeCl3= 0,2 + 0,2 = 0,4 (mol)
NaOH + HCl→ NaCl + H2O (5)
2NaOH + FeCl2 →Fe(OH)2 + 2NaCl (6)
0,3 0,3
3NaOH + FeCl3 →Fe(OH)3 + 3NaCl (7)
0,4 0,4
2Fe(OH)3→ Fe2O3 + 3H2O (8)
0,4 0,2
4Fe(OH)2 + O2→ 2Fe2O3 + 4H2O (9)
0,3 0,15
Từ (8) và (9)
m = mFe2O3= (0,2 + 0,15) . 160 = 56 (gam)
Câu 7
a)
nH2= 4,368/22,4 = 0,195 (mol)
Mg + H2SO4 → MgSO4 + H2 (1)
Mg + 2HCl →MgCl2 + H2 (2)
2Al + 3H2SO4 →Al2(SO4)3 + 3H2 (3)
2Al + 6HCl →2AlCl3 + 3H2 (4)
nHCl = 0,25. 1 = 0,25 (mol)
nH2SO4 = 0,25. 0,5 = 0,125 (mol)
Nếu HCl và H2SO4 phản ứng hết thì:
Theo (2) và (4) = nH2 = 1/2 nHCl = 0,125 (mol)
Theo (1) và (3) = nH2 = nH2SO4 = 0,125 (mol)
Vậy = 0,125 + 0,125 = 0,25 > 0,195 => dung dịch B vẫn còn dư axit.
b)
Gọi số mol H2 do Al phản ứng sinh ra là a mol => số mol Al là (2/3) a mol.
Gọi số mol H2 do Mg phản ứng sinh ra là b mol => số mol Mg là b mol.
Theo bài ra ta có: a + b = 0,195 (mol) (5)
(2/3)a .27 + b.24 = 3,87 (gam) ( 6)
Từ (5) và (6) ta giải được b = 0,06 (mol)
a = 0,135 (mol)
% Mg = (0,06.24/3,87). 100% = 37,2%
%Al = 100 – 37,2 = 62,8 %
Câu 8
Cốc thứ nhất: Số mol CaCO3 = 25 :100 = 0,25 mol.
CaCO3 + 2HCl →CaCl2 + CO2 + H2O
0.25 0,25
khối lượng tăng thêm: 25 – 0,25 x 44 = 14gam.
Để cân thăng bằng, ở cốc thứ hai, sau khi H2 bay đi, thì khối lượng cũng phải tăng 14 gam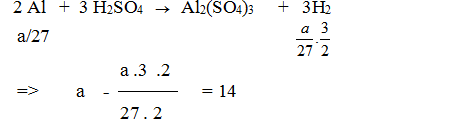
Giải được a = 15,75gam.
Câu 9
Ta có RO + H2SO4→ RSO4 + H2O
(R + 16) 98g (R + 96)g
Giả sử hoà tan 1 mol RO
Khối lượng dd thu được = (R + 16) + (98 : 4,9).100 = R + 2016
C%(RSO4)= (R+96/R+2016)x100% = 5,87%
Giải phương trình ta được: R = 24, kim loại hoá trị II là Mg.




