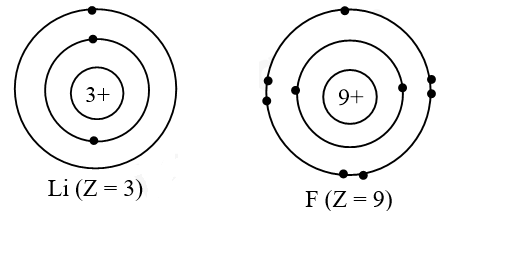
Hóa học
-
 Tiểu Thư
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Tiểu Thư
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Mèo Ú
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Mèo Ú
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 shinichiro
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
shinichiro
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Mèo Ú
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Mèo Ú
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Kẹo Ngọt
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Kẹo Ngọt
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Thị Phương Tuyết
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Thị Phương Tuyết
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Cô Lệ - Tiếng Anh Tiểu học
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Cô Lệ - Tiếng Anh Tiểu học
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nai Con
Hóa học
1 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nai Con
Hóa học
1 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Milky Nugget
Hóa học
1 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Milky Nugget
Hóa học
1 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Lanh chanh
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Lanh chanh
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 shinichiro
Hóa học
1 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
shinichiro
Hóa học
1 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Lê Jelar
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Lê Jelar
Hóa học
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời