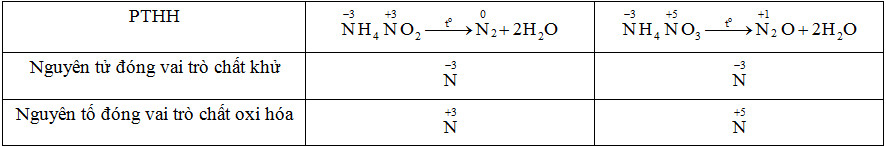
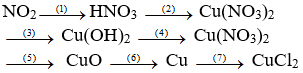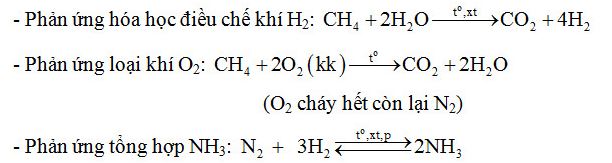Hóa học
-
 Nguyễn Linh An
Hóa học
Lớp 11
2 câu trả lờiThích Bình luận Xem thêm 1 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
2 câu trả lờiThích Bình luận Xem thêm 1 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 11
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 11
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 11
2 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
2 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 11
2 câu trả lờiThích Bình luận Xem thêm 1 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
2 câu trả lờiThích Bình luận Xem thêm 1 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 11
1 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
1 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 11
2 câu trả lờiThích Bình luận Xem thêm 1 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
2 câu trả lờiThích Bình luận Xem thêm 1 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 11
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 11
2 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
2 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 11
2 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
2 3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 11
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
3 câu trả lờiThích Bình luận Xem thêm 2 câu trả lời -
 Nguyễn Linh An
Hóa học
Lớp 11
2 câu trả lờiThích Bình luận Xem thêm 1 câu trả lời
Nguyễn Linh An
Hóa học
Lớp 11
2 câu trả lờiThích Bình luận Xem thêm 1 câu trả lời