Lý thuyết Khoa học tự nhiên 9 Cánh diều bài 21
VnDoc xin giới thiệu bài Lý thuyết Khoa học tự nhiên 9 bài 21: Alkene có nội dung chi tiết và các câu trắc nghiệm trong chương trình sách mới. Các bạn có thể tham khảo để chuẩn bị tốt cho bài học mới trong chương trình sách Cánh diều.
Bài: Alkene
I. Khái niệm Alkene
- Alkene là những hydrocarbon mạch hở, trong phân tử có một liên kết đôi.
Ví dụ:
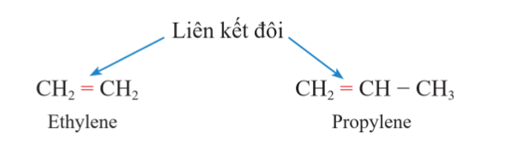
- Alkene có công thức chung là CnH2n (với n≥2).
II. Ethylene
1. Công thức cấu tạo và tính chất vật lí
- Ethylene có công thức phân tử C2H4 và công thức cấu tạo như sau:
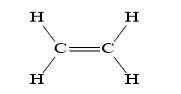
+ Công thức cấu tạo thu gọn: CH2 = CH2
+ Trong phân tử ethylene, giữa hai nguyên tử carbon có một liên kết đôi. Trong liên kết đôi có một liên kết kém bền, chính liên kết này tạo ra những tính chất hoá học đặc trưng cho ethylene nói riêng và các alkene khác nói chung.
- Ở điều kiện thường, ethylene là chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
2. Tính chất hóa học
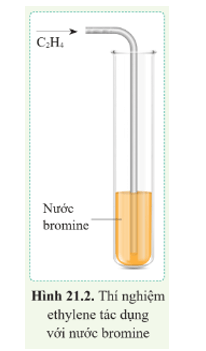
a. Phản ứng làm mất màu nước bromine
- Các alkene làm mất màu nước bromine
Ví dụ: ethylene phản ứng với Br2 trong dung dịch theo phương trình hoá học:
CH2 = CH2 + Br2 → BrCH2 – CH2Br
- Trong phản ứng làm mất màu nước bromine, phân tử bromine đã cộng hợp vào nối đôi trong phân tử alkene, liên kết kém bền trong liên kết đôi bị phá vỡ để tạo thành sản phẩm. Phản ứng được gọi là phản ứng cộng.
b. Phản ứng trùng hợp
- Ở điều kiện thích hợp, các phân tử ethylene cộng hợp liên tiếp với nhau, liên kết kém bền trong liên kết đôi của phân tử ethylene bị phá vỡ tạo polyethylene (PE) theo phương trình hoá học sau:
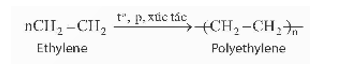
Phản ứng trên được gọi là phản ứng trùng hợp.
- Nhiều alkene khác cũng tham gia phản ứng trùng hợp.
c. Phản ứng cháy
- Các alkene khi cháy đều tạo ra khí CO2 và H2O.
- Ví dụ: C2H4+3O2![]() \(\overset{t°}{\rightarrow}\)2CO2+2H2O
\(\overset{t°}{\rightarrow}\)2CO2+2H2O
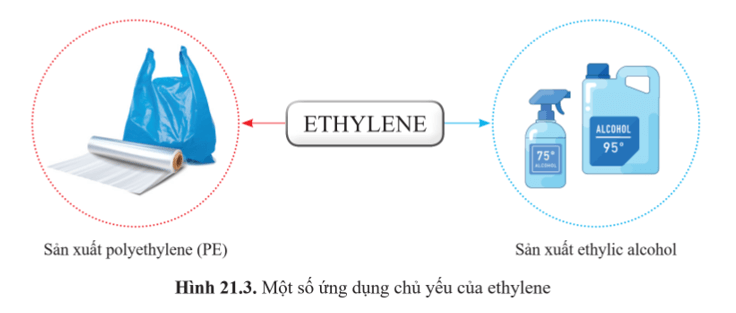
3. Ứng dụng
Một số ứng dụng quan trọng của ethylene được trình bày trong hình:.
>>>> Bài tiếp theo: Lý thuyết Khoa học tự nhiên 9 Cánh diều bài 22









