-
-
-
Mầm non
-
Lớp 1
-
Lớp 2
-
Lớp 3
-
Lớp 4
-
Lớp 5
-
Lớp 6
-
Lớp 7
-
Lớp 8
-
Lớp 9
-
Lớp 10
-
Lớp 11
-
Lớp 12
-
Thi vào lớp 6
-
Thi vào lớp 10
-
Thi Tốt Nghiệp THPT
-
Đánh Giá Năng Lực
-
Khóa Học Trực Tuyến
-
Hỏi bài
-
Trắc nghiệm Online
-
Tiếng Anh
-
Thư viện Học liệu
-
Bài tập Cuối tuần
-
Bài tập Hàng ngày
-
Thư viện Đề thi
-
Giáo án - Bài giảng
-
Tất cả danh mục
-
- Mầm non
- Lớp 1
- Lớp 2
- Lớp 3
- Lớp 4
- Lớp 5
- Lớp 6
- Lớp 7
- Lớp 8
- Lớp 9
- Lớp 10
- Lớp 11
- Lớp 12
- Thi Chuyển Cấp
-
fe hno3 đặc nóng
-

Cu + H2SO4 → CuSO4 + SO2 + H2O
Cu H2SO4 đặc nóng Cu H2SO4: Cu + H2SO4 → CuSO4 + SO2 + H2O là phương trình oxi hóa khử, khi cho đồng tác dụng với dung dịch H2SO4 đặc sản phẩm sinh ra là muối đồng sunfat và khí lưu huỳnh đioxit SO2 có mùi hắc 391.293 -

Al + HNO3 → Al(NO3)3 + N2O + H2O
Al HNO3 loãng Al HNO3: Al + HNO3 → Al(NO3)3 + N2O + H2O được VnDoc biên soạn hướng dẫn các bạn học sinh cân bằng phương trình oxi hóa khử bằng phương pháp thằng bằng eletron khi cho Al tác dụng HNO3 loãng ra N2O. 327.254
-

Al + H2SO4 → Al2(SO4)3 + SO2 + H2O
Al H2SO4 đặc nóng Al H2SO4 đặc nóng: Cân bằng phản ứng oxi hóa khử Al + H2SO4 → Al2(SO4)3 + SO2 + H2O được VnDoc biên soạn hướng dẫn các bạn học sinh viết và cân bằng phương trình theo phương pháp thăng bằng electron. 283.638 -
S + H2SO4 → SO2 + H2O
H2SO4 ra SO2 S H2SO4: S + H2SO4 → SO2 + H2O được VnDoc biên soạn là phương trình thể hiện tính khử của lưu huỳnh, sản phẩm của phản ứng sinh ra khí lưu huỳnh dioxit có mùi hắc, và độc. 160.948 -

Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Al HNO3 loãng Al ra NH4NO3: Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O được VnDoc biên soạn hướng dẫn bạn đọc viết và cân bằng phản ứng Al tác dụng với HNO3 sinh ra NH4NO3. Từ đó vận dụng giải các dạng bài tập liên quan. 154.194 -

Mg + H2SO4 → MgSO4 + SO2 + H2O
Mg H2SO4 đặc nóng Mg H2SO4 đặc: Mg + H2SO4 → MgSO4 + SO2 + H2O là phương trình phản ứng oxi hóa khử được VnDoc biên soạn hướng dẫn các bạn học sinh viết và cân bằng phương trình phản ứng Mg tác dụng với H2SO4 đặc nóng. 119.692 -

Zn + H2SO4 → ZnSO4 + SO2 + H2O
Zn H2SO4 đặc nóng Zn H2SO4: Zn + H2SO4 → ZnSO4 + SO2 + H2O được VnDoc gửi tới bạn đọc là phương trình hóa học giữa kẽm và h2so4 đặc. Mời các bạn tham khảo. 98.086 -

Mg + HNO3 → Mg(NO3)2 + N2O + H2O
Mg HNO3 ra N2O Mg HNO3 loãng: Mg + HNO3 → Mg(NO3)2 + N2O + H2O gửi tới bạn đọc là phương trình phản ứng oxi hóa khử giữa Mg và dung dịch axit HNO3. Mời các bạn tham khảo. 79.107 -
FeS + H2SO4 → Fe2(SO4)3 + SO2 + H2O
FeS H2SO4 đặc nóng FeS H2SO4: FeS+H2SO4 → Fe2(SO4)3+SO2+H2O được biên soạn hướng dẫn bạn đọc viết và cân bằng phương trình phản ứng hóa học. Cũng như đưa ra các nội dung câu hỏi liên quan đến phản ứng FeS H2SO4 đặc nóng. 68.638 -

Ag + H2SO4 → Ag2SO4 + SO2 + H2O
Ag H2SO4 đặc nóng Ag H2SO4: Ag + H2SO4 → Ag2SO4 + SO2 + H2O được biên soạn gửi tới bạn đọc là phương trình phản ứng Ag tác dụng H2SO4 đặc. 61.466 -
FeCO3 + H2SO4 → Fe2(SO4)3 + SO2 + CO2 + H2O
FeCO3 H2SO4 đặc nóng FeCO3 H2SO4 đặc: FeCO3 + H2SO4 → Fe2(SO4)3 + SO2 + CO2 + H2O được VnDoc biên soạn hướng dẫn cân bằng phản ứng oxi hóa khử khi cho FeCO3 tác dụng với dung dịch H2SO4 đặc nóng. Mời các bạn tham khảo. 49.281 -

FeSO4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O
FeSO4 ra Fe2(SO4)3 FeSO4 H2SO4: FeSO4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O biên soạn hướng dẫn bạn đọc trả lời câu hỏi liên quan đến FeSO4 H2SO4 đặc nóng. Mời các bạn tham khảo. 37.894 -
Khi đun nóng ancol etylic với H2SO4 đặc ở 170 độ C thì sẽ tạo ra sản phẩm chính là
Đun nóng ancol etylic với axit H2SO4 đặc ở 170oC thu được sản phẩm hữu cơ chính là Khi đun nóng ancol etylic với H2SO4 đặc ở 170 độ C thì sẽ tạo ra sản phẩm chính là biên soạn hướng dẫn bạn đọc dựa vào tính chất hóa học của rượu etylic để hoàn thành câu hỏi. 34.354 -
NH3 + HNO3 → NH4NO3
HNO3 ra NH4NO3 NH3 HNO3: NH3 + HNO3 → NH4NO3 được biên soạn hướng dẫn các bạn viết và cân bằng đúng phương trình phản ứng HNO3 ra NH4NO3. Mời các bạn tham khảo. 26.462 -
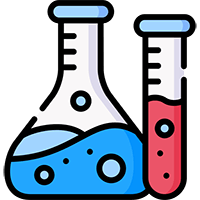
Mg + HNO3 → Mg(NO3)2 + N2 + H2O
Mg HNO3 ra N2 Mg HNO3 N2: Mg + HNO3 → Mg(NO3)2 + N2 + H2O được VnDoc biên soạn hướng dẫn các bạn học sinh viết và cân bằng phương trình khi cho Mg tác dụng với axit HNO3. Mời các bạn tham khảo. 8.622 -

Giải bài tập SGK Địa lý lớp 7 bài 12: Thực hành nhận biết đặc điểm môi trường đới nóng
Giải bài tập SGK Địa lý lớp 7 bài 12 VnDoc.com xin giới thiệu đến các bạn: Giải bài tập SGK Địa lý lớp 7 bài 12: Thực hành nhận biết đặc điểm môi trường đới nóng. Mời các bạn tham khảo để chuẩn bị tốt cho kì thi học kì sắp tới. Hy vọng, đây sẽ là tài liệu hay và hữu ích giúp các bạn ôn tập và rèn luyện kỹ năng giải đề, tự tin bước vào kì thi các bạn nhé! 7.042 -

Giáo án Vật lý lớp 6 bài Sự nóng chảy và sự đông đặc
Giáo án điện tử môn Vật lý lớp 6 Dưới đây là giáo án Vật lý lớp 6 bài “Sự nóng chảy và sự đông đặc” được biên soạn đầy đủ, cẩn thận, mời các bạn cùng tải về dùng cho buổi lên lớp của mình. 1.805 -
Axit H2SO4 loãng tác dụng với Fe tạo thành sản phẩm
Fe tác dụng với H2SO4 loãng Axit sunfuric đặc nguội có thể đựng trong bình chứa làm bằng được biên soạn hướng dẫn bạn đọc trả lời câu hỏi liên quan đến phản ứng Fe tác dụng với H2SO4 loãng. Mời các bạn tham khảo. 1.514 -
Fe + AgNO3 → Fe(NO3)2 + Ag
Fe ra Fe(NO3)2 Fe AgNO3: Fe + AgNO3 → Fe(NO3)2 + Ag biên soạn hướng dẫn bạn đọc viết và cân bằng chính xác phản ứng Fe ra Fe(NO3)2. Mời các bạn tham khảo chi tiết 1.446 -
Hoàn thành PTHH sau: FeS + HNO3 → NO2 + Fe(NO3)3 + H2O + H2SO4
Ôn tập môn Hóa học 10 VnDoc xin giới thiệu tới các bạn bài Hoàn thành PTHH sau: FeS + HNO3 → NO2 + Fe(NO3)3 + H2O + H2SO4 để tham khảo chuẩn bị cho bài giảng học kì mới sắp tới đây của mình. 967 -

Giải bài tập SBT Địa lý 12 bài 21: Đặc điểm nền nông nghiệp nước ta
Giải bài tập SBT Địa lý 12 Tài liệu Giải bài tập SBT Địa lý 12 bài 21: Đặc điểm nền nông nghiệp nước ta sẽ là nguồn thông tin hữu ích để giúp các bạn học sinh học tập hiệu quả hơn môn Địa lý. 621 -

Ngành sản xuất nông nghiệp có những đặc điểm gì? Theo em, đặc điểm nào là quan trọng nhất?
Ngành sản xuất nông nghiệp có những đặc điểm gì? Theo em, đặc điểm nào là quan trọng nhất? 18 -

Fe + HNO3 ---> Fe(NO3)3 + N2 + H2Ob nào giải mã khúc mắc câu này ch
3


































