Base
1. Khái niệm base
Base là hợp chất mà phân tử có một nguyên tử kim loại liên kết với một hay nhiều nhóm hydroxide (OH−). Khi tan trong nước, phân tử base sẽ tạo ra ion OH−.
Ví dụ:
Sodium hydroxide có công thức hoá học là NaOH. Sodium hydroxide là chất rắn, tan tốt trong nước và khi tan toả nhiều nhiệt.

Hình 1: Sodium hydroxide (NaOH)
Khi tan trong nước, phân tử NaOH tạo ra ion hydroxide (OH-):
NaOH → Na+ + OH−
Một số base khác: Ca(OH)2, Mg(OH)2, Fe(OH)3,...
2. Tính tan trong nước của các base
Dựa vào khả năng hoà tan trong nước, các base được chia làm 2 loại:
- Base tan tốt trong nước gọi là kiềm: NaOH, KOH, LiOH, Ba(OH)2, …
- Một số base không tan được trong nước: Fe(OH)3, Mg(OH)2, Cu(OH)2, Fe(OH)2, …

Hình 2: Một số base không tan trong nước
Mở rộng:
Phèn chua (phèn nhôm - kali) có tên khoa học potassium aluminium sulfate và công thức hóa học KAl(SO4)2.12H2O. Khi cho phèn chua vào nước sẽ tạo ra phản ứng làm xuất hiện kết tủa bông keo Al(OH)3, chính Al(OH)3 sẽ hút các hạt lơ lửng vào khối kết tủa để lắng xuống, giúp nước trở nên trong hơn. Vì vậy, hiện nay phèn chua được sử dụng như một hóa chất xử lí nước thông dụng.

Hình 3: Phèn chua
II. Tính chất hoá học của base
1. Dung dịch base (kiềm) làm đổi màu chất chỉ thị
Dung dịch base làm đổi màu quỳ tím thành màu xanh và làm dung dịch phenolphthalein không màu thành màu hồng.
Ví dụ:
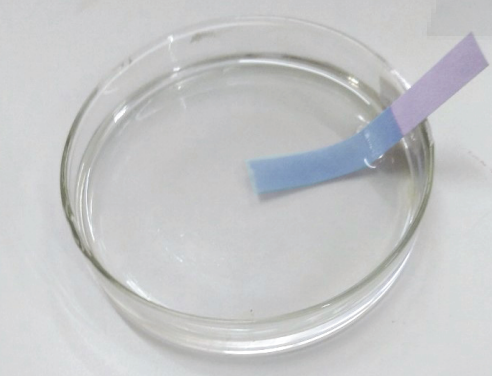
Hình 4: Dung dịch NaOH làm quỳ tím đổi màu


Hình 5: Dung dịch NaOH làm đổi màu phenolphthalein
2. Base tác dụng với acid
Base tác dụng với một số acid tạo thành muối và nước.
Ví dụ:
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
Các base có nhiều ứng dụng trong đời sống và công nghiệp.
Ví dụ: NaOH là hóa chất cơ bản để sản xuất ra xà phòng, chất tẩy rửa, bột giặt, ...; Ca(OH)2 dùng trong việc khử chua đất trồng trọt, khử độc chất thải sinh hoạt, xác chết động vật hay xử lí nước thải sinh hoạt hoặc chất thải công nghiệp; ...








