Muối
1. Tìm hiểu về muối
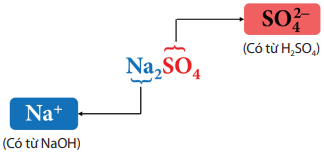
Muối là hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
Ví dụ: Na2SO4 là muối có thành phần sau:
2. Tên gọi của muối
- Cách gọi tên muối của kim loại:
Tên kim loại + hoá trị (kim loại nhiều hoá trị) + tên gốc acid
- Cách gọi tên muối của ammonium (NH4+).
Ammonium + tên gốc acid
Ví dụ: một số muối và tên gọi tương ứng:
| Tên muối | Công thức hóa học |
| Potassium carbonate | K2CO3 |
| Iron(III) sulfate | Fe2(SO4)3 |
| Copper(II) chloride | CuCl2 |
| Ammonium nitrate | NH4NO3 |
| Sodium acetate | CH3COONa |
| Calcium phosphate | Ca3(PO4)2 |
II. Tính tan của muối trong nước
Tuỳ thuộc vào khả năng tan trong nước của muối, ta có: muối tan, muối không tan hoặc ít tan.
Một số muối tan được trong nước:
- Tất cả các muối của kim loại nhóm IA (Li, Na, K, …)
- Tất cả các muối ammonium.
- Tất cả các muối nitrate.
- Các muối sulfate ngoại trừ BaSO4, PbSO4.
- Các muối chloride ngoại trừ AgCl, PbCl2.
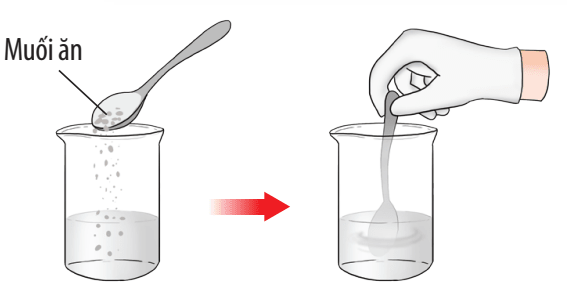
Hình 1: Hình minh họa hoà tan muối ăn (NaCl) vào nước
Một số muối không tan trong nước:
- Các muối carbonate ngoại trừ Na2CO3, K2CO3, (NH4)2CO3 …
- BaSO4, PbSO4 …
- AgCl, PbCl2 …
III. Điều chế muối
Các phương pháp điều chế muối từ:
- Oxide acid:
Oxide acid + Base → Muối + H2O
Ví dụ: SO2 + Ba(OH)2 → BaSO3 + H2O.
- Oxide base:
Oxide base + Acid → Muối + H2O
Ví dụ: FeO + 2HCl → FeCl2 + H2O
- Dung dịch acid và base:
Acid + Base → Muối + H2O
Ví dụ: HCl + NaOH → NaCl + H2O
- Kim loại và acid:
M + (HCl, H2SO4 loãng, …) → Muối + H2↑
M là một số kim loại như Mg, Al, Zn, Fe, …
Ví dụ: Fe + 2HCl → FeCl2 + H2↑
Ngoài ra, đa số kim loại tác dụng với phi kim thu được muối.
Ví dụ: Đốt dây sắt trong bình khí chlorine thu được muối FeCl3.

Hình 2: Đốt dây sắt trong bình khí chlorine
IV. Tính chất hoá học của muối
Một số tính chất hoá học của muối:
- Dung dịch muối phản ứng với kim loại (KL):
Muối KL(A) + KL(B) → Muối KL(B) + KL(A) (1)
Ví dụ: Fe + CuSO4 → FeSO4 + Cu.

Hình 3: Thí nghiệm sắt phản ứng với dung dịch copper(II) sulfate
Chú ý: Phản ứng trên xảy ra theo quy luật kim loại mạnh (không tan trong nước) đẩy kim loại yếu hơn ra khỏi dung dịch muối.
- Dung dịch muối phản ứng với dung dịch base:
Muối + Base → Muối mới + Base mới (2)
Ví dụ: 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl.

Hình 4: Thí nghiệm cho dung dịch sodium hydroxide
tác dụng với dung dịch copper (II) sulfate
- Dung dịch muối phản ứng với dung dịch acid:
Muối + Acid → Muối mới + Acid mới (3)
Ví dụ: Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O.

Hình 5: Thí nghiệm cho dung dịch hydrochloric acid
phản ứng với dung dịch sodium carbonate
- Dung dịch muối phản ứng với dung dịch muối:
Muối (A) + Muối (B) → Muối (C) + Muối (D) (4)
Ví dụ: AgNO3 + NaCl → AgCl↓ + NaNO3
Chú ý: Điều kiện để có phản ứng (2), (3), (4) là sản phẩm phải có ít nhất một trong các chất sau: chất kết tủa, chất khí, nước.

Hình 6: Thí nghiệm cho dung dịch silver nitrate
phản ứng với dung dịch sodium chlorine
V. Mối quan hệ giữa acid, base, oxide và muối
Các hợp chất acid, base, oxide, muối có quan hệ với nhau theo sơ đồ sau:
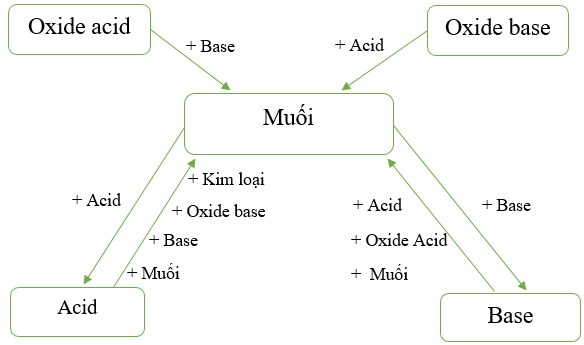
Hình 7: Sơ đồ mối quan hệ giữa acid, base, oxide, muối