Nồng độ dung dịch
Khi hòa tan đường hay muối (chất rắn) và nước (chất lỏng) sẽ tạo thành nước đường hay nước muối (hỗn hợp đồng nhất).
Hình 1: Hòa tan muối trong nước
Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi.
II. Độ tan của một chất trong nước
Độ tan của một chất trong nước là số gam tối đa chất đó hoà tan trong 100 gam nước để tạo thành dung dịch bão hoà ở một nhiệt độ, áp suất xác định.
- Độ tan được tính theo công thức:
![]() \(\mathrm S\;=\;\frac{{\mathrm m}_{\mathrm{ct}}}{{\mathrm m}_{\mathrm{dm}}}\times100\)
\(\mathrm S\;=\;\frac{{\mathrm m}_{\mathrm{ct}}}{{\mathrm m}_{\mathrm{dm}}}\times100\)
Trong đó:
S là độ tan (đơn vị gam/100 gam nước);
mct là khối lượng chất tan (đơn vị gam);
mdm là khối lượng dung môi (đơn vị gam);
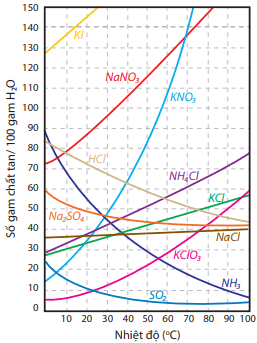
- Nói chung, độ tan của chất rắn sẽ tăng khi tăng nhiệt độ (trừ một số ít trường hợp); độ tan của chất khí sẽ tăng khi giảm nhiệt độ và tăng áp suất.
III. Nồng độ dung dịch
- Nồng độ dung dịch cho phép ta đánh giá độ "đặc", "loãng" của một dung dịch, được xác định bằng lượng chất hòa tan trong một lượng dung môi nhất định.
- Có nhiều cách để biểu thị nồng độ dung dịch, hay sử dụng là nồng độ phần trăm và nồng độ mol.
1. Tính nồng độ phần trăm của dung dịch
Nồng độ phần trăm (kí hiệu C%) của một dung dịch là số gam chất tan có trong 100 gam dung dịch.
Công thức tính nồng độ phần trăm của dung dịch:
![]() \(\mathrm C\%=\frac{{\mathrm m}_{\mathrm{ct}}}{{\mathrm m}_{\mathrm{dd}}}\times100\;(\%)\)
\(\mathrm C\%=\frac{{\mathrm m}_{\mathrm{ct}}}{{\mathrm m}_{\mathrm{dd}}}\times100\;(\%)\)
Trong đó:
mct: khối lượng chất tan (đơn vị gam);
mdd: khối lượng dung dịch (đơn vị gam).
Ví dụ:
Hoà tan 21 gam KNO3 vào 129 gam nước thu được dung dịch KNO3. Tính nồng độ phần trăm của dung dịch KNO3 thu được.
Hướng dẫn giải:
Khối lượng dung dịch = khối lượng dung môi + khối lượng chất tan
![]() \(\Rightarrow\) mdd = 129 + 21 = 150 gam.
\(\Rightarrow\) mdd = 129 + 21 = 150 gam.
Nồng độ phần trăm của dung dịch KNO3 thu được là:
![]() \(\mathrm C\%=\frac{{\mathrm m}_{\mathrm{ct}}}{{\mathrm m}_{\mathrm{dd}}}\times100(\%)=\frac{21}{150}\times100(\%)\;=\;14(\%)\)
\(\mathrm C\%=\frac{{\mathrm m}_{\mathrm{ct}}}{{\mathrm m}_{\mathrm{dd}}}\times100(\%)=\frac{21}{150}\times100(\%)\;=\;14(\%)\)
2. Tính nồng độ mol của dung dịch
Nồng độ mol (kí hiệu CM) của dung dịch là số mol chất tan (n) có trong 1 lít dung dịch.
Công thức tính nồng độ mol của dung dịch:
![]() \(\mathrm C_{\mathrm M} =\frac{\mathrm n}{\mathrm V_{\mathrm d\mathrm d} }\)
\(\mathrm C_{\mathrm M} =\frac{\mathrm n}{\mathrm V_{\mathrm d\mathrm d} }\)
Trong đó:
n: số mol chất tan (đơn vị mol);
Vdd: thể tích dung dịch (đơn vị lít, L);
CM: nồng độ mol của dung dịch (đơn vị mol/L hoặc M).
Ví dụ:
Hoà tan 16 gam CuSO4 khan vào nước thu được 200 ml dung dịch CuSO4. Tính nồng độ mol của dung dịch CuSO4.
Hướng dẫn giải:
Số mol chất tan: ![]() \({\mathrm n}_{{\mathrm{CuSO}}_4}=\frac{16}{160}=0,1\;(\mathrm{mol})\)
\({\mathrm n}_{{\mathrm{CuSO}}_4}=\frac{16}{160}=0,1\;(\mathrm{mol})\)
Đổi 200 ml = 0,2 lít.
Nồng độ mol của dung dịch CuSO4 là:
![]() \({\mathrm C}_{\mathrm M}=\frac{\mathrm n}{{\mathrm V}_{\mathrm{dd}}}=\frac{0,1}{0,2}=0,5\;(\mathrm M)\)
\({\mathrm C}_{\mathrm M}=\frac{\mathrm n}{{\mathrm V}_{\mathrm{dd}}}=\frac{0,1}{0,2}=0,5\;(\mathrm M)\)
IV. Pha chế dung dịch
Để pha chế một dung dịch có nồng độ cho trước, ta cần phải biết lượng chất tan (khối lượng hay số mol) cần dùng để hoà tan trong một lượng dung môi.
Ví dụ 1: Pha chế 50 gam dung dịch NaCl có nồng độ 10%.
Dụng cụ và hoá chất: 1 cốc thuỷ tinh, đũa thuỷ tinh, cân đồng hồ hoặc cân điện tử, calcium chloride (NaCl) khan, nước cất.
| Tính toán | Cách pha chế |
mdm = mdd – mct = 50 – 5 = 45 (gam). |
|
Ví dụ 2: Từ muối ăn NaCl, nước cất và các dụng cụ cần thiết. Hãy tính toán và nêu cách pha chế 100 mL dung dịch NaCl có nồng độ 1 M.
| Tính toán | Cách pha chế |
mNaCl = 0,1 × 58,5 = 5,85 (gam). |
|








