Các dạng toán về Axit Nitric
CÁC DẠNG TOÁN VỀ AXIT NITRIC
Nhằm giúp các bạn học sinh ôn tập và củng cố kiến thức môn Hóa học phần axit nitric, giáo viên Nguyễn Phúc Linh đã biên soạn và tổng hợp nên tài liệu: Các dạng toán về Axit Nitric.
Giải bài tập trang 45 SGK Hóa học lớp 11: Axit nitric và muối nitrat
A. MỘT SỐ CHÚ Ý
I. Tính oxi hóa của HNO3
HNO3 thể hiện tính oxi hóa mạnh khi tác dụng với các chất có tính khử như: Kim loại, phi kim, các hợp chất Fe(II), hợp chất S2-, I-,... Thông thường:
+ Nếu axit đặc, nóng tạo ra sản phẩm NO2
+ Nếu axit loãng, thường cho ra NO. Nếu chất khử có tính khử mạnh, nồng độ axit và nhiệt độ thích hợp có thể cho ra N2O, N2, NH4NO3.
* Chú ý:
1. Một số kim loại (Fe, Al, Cr, . . .) không tan trong axit HNO3 đặc, nguội do bị thụ động hóa.
2. Trong một số bài toán ta phải chú ý biện luận trường hợp tạo ra các sản phẩm khác: NH4NO3 dựa theo phương pháp bảo toàn e (nếu ne cho > ne nhận để tạo khí) hoặc dựa theo dữ kiện đề bài (chẳng hạn cho dung dịch NaOH vào dung dịch sau phản ứng thấy có khí thoát ra) hoặc các hợp chất khí của Nitơ dựa vào tỉ khối hơi của hỗn hợp đã cho.
3. Khi axit HNO3 tác bazơ, oxit bazơ không có tính khử chỉ xảy ra phản ứng trung hòa.
4. Với kim loại có nhiều hóa trị (như Fe, Cr), nếu dùng dư axit sẽ tạo muối hóa trị 3 của kim loại (Fe3+, Cr3+); nếu axit dùng thiếu, dư kim loại sẽ tạo muối hóa trị 2 (Fe2+, Cr2+), hoặc có thể tạo đồng thời 2 loại muối.
5. Các chất khử phản ứng với muối NO3- trong môi trường axit tương tự phản ứng với HNO3. Ta cần quan tâm bản chất phản ứng là phương trình ion.
II. Nguyên tắc giải bài tập: Dùng định luật bảo toàn e.
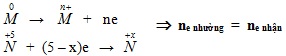
* Đặc biệt:
+ Nếu phản ứng tạo ra nhiều sản phẩm khử của N thì ne nhường = ne nhận
+ Nếu có nhiều chất khử tham gia phản ứng ne nhường = ne nhận
- Trong một số trường hợp cần kết hợp với định luật bảo toàn điện tích (tổng điện tích dương = tổng điện tích âm) và định luật bảo toàn nguyên tố
- Có thể sử dụng phương trình ion – electron hoặc các bán phản ứng để biểu diễn các quá trình.
![]()
+ Đặc biệt trong trường hợp kim loại tác dụng với axit HNO3 ta có:
nHNO3 (pư) = 2nNO2 = 4nNO = 10nN2O = 12nN2 = 10nNH4NO3
nNO3- (trong muối) = nNO2 = 3nNO = 8nN2O = 10nN2 = 8nNH4NO3
Nếu hỗn hợp gồm cả kim loại và oxit kim loại phản ứng với HNO3 (và giả sử tạo ra khí NO) thì:
nHNO3 (pư) = 4nNO + 2nO (trong oxit KL)
III. Một số Ví dụ
VD1. Hoà tan hoàn toàn m g bột Cu trong 800 g dung dịch HNO3 được dung dịch Y và 2,24 lit khí NO (đktc). Y tác dụng vừa đủ với 300 ml dung dịch NaOH 2 M được kết tủa R. Sau khi nung R đến khối lượng không đổi thu được 20 g chất rắn.
a. Tính khối lượng Cu ban đầu.
b. Tính khối lượng các chất trong Y và nồng độ % của dung dịch HNO3 đã dùng.
VD2. Cho 11 g hỗn hợp hai kim loại Al và Fe vào dung dịch HNO3 loãng dư, thu được 6,72 lit khí NO (đktc) duy nhất. Khối lượng (g) của Al và Fe trong hỗn hợp đầu là:
A. 5,4 và 5,6. B. 5,6 và 5,4. C. 4,4 và 6,6. D. 4,6 và 6,4.

