Chỉ ra sự khác nhau giữa liên kết kim loại và liên kết ion
Chỉ ra sự khác nhau giữa liên kết kim loại và liên kết ion được VnDoc biên soạn, tổng hợp giúp bạn học có thể so sánh được liên kết kim loại khác liên kết ion, từ đó củng cố nội dung kiến thức, làm các dạng bài tập liên quan đến Hóa 12 Chủ đề 6 Đại cương kim loại.
Sự khác nhau giữa liên kết kim loại và liên kết ion
| Liên kết kim loại | Liên kết ion | |
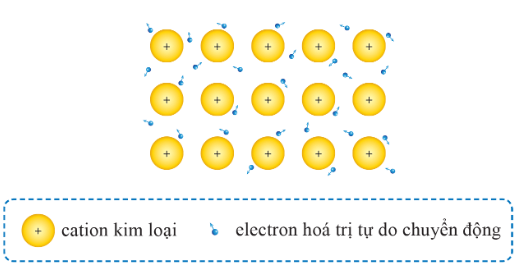
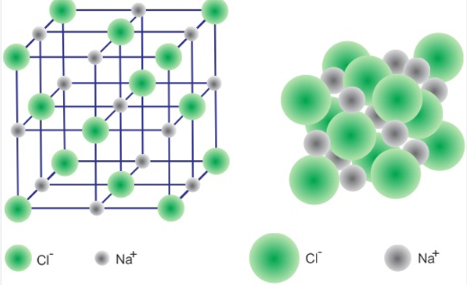
| Khái niệm | Liên kết kim loại là liên kết được hình thành từ lực hút tĩnh điện giữa các cation kim loại và các electron tự do trong tinh thể kim loại. | Liên kết ion được tạo thành nhờ lực hút tĩnh điện giữa các ion mang điện tích trái dấu. |
| Khác nhau | lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại. | do lực hút tĩnh điện giữa các ion mang điện tích trái dấu. |
| Ví dụ |
Mô hình mô tả khái quát các electron tự do trong kim loại và ion dương kim loại trong tinh thể kim loại |
Mô hình mạng tinh thể Sodium chloride |
Câu hỏi vận dụng liên quan
Câu 1. Phát biểu nào sau đây về liên kết kim loại là đúng?
A. Liên kết kim loại là liên kết được hình thành từ lực hút tính điện giữa các cation kim loại và các electron hóa trị tự do. Vì vậy, liên kết kim loại cũng chính là liên kết ion.
B. Liên kết kim loại được hình thành do giữa các nguyên tử kim loại có sự dùng chung các electron hóa trị tự do. Vì vậy, liên kết kim loại cũng chính là liên kết cộng hóa trị.
C. Liên kết kim loại là liên kết được hình thành từ lực hút tính điện giữa các cation kim loại và các electron hóa trị tự do trong tinh thể kim loại.
D. Liên kết kim loại là liên kết được hình thành do sự xen phủ các orbital chứa electron hóa trị tự do của các nguyên tử kim loại.
Liên kết kim loại là liên kết được hình thành từ lực hút tính điện giữa các cation kim loại và các electron hóa trị tự do trong tinh thể kim loại.
Câu 2. Cho các phát biểu sau
(a) Ở điều kiện thường, tất cả các kim loại đều tồn tại ở thể rắn và có cấu tạo tinh thể.
(b) Các cation kim loại và nguyên tử kim loại được sắp xếp trật tự trong tinh thể kim loại.
(c) Electron hóa trị của nguyên tử kim loại chịu lực hút yếu của hạt nguyên tử.
(d) Giống như liên kết ion, liên kết kim loại cũng được hình thành từ tương tác tĩnh điện.
(e) Các electron hóa trị tự do di chuyển trong cấu trúc tinh thể kim loại tạo ra dòng điện.
Số phát biểu đúng là:
A. 3.
B. 4.
C. 5.
D. 2.
(a) Sai vì ở điều kiện thường, hầu hết các kim loại tồn tại ở thể rắn và có cấu tạo tinh thể, ngoại trừ thủy ngân (Hg), kim loại tồn tại ở thể lỏng.
(b) Đúng.
(c) Đúng.
(d) Đúng.
(e) Đúng.
Câu 3. Trong định nghĩa về liên kết kim loại: “ Liên kết kim loại là liên kết hình thành do lực hút tĩnh điện giữa các electron...(1)... với các ion...(2)... kim loại ở các nút mạng.
Các từ cần điền vào vị trí (1), (2) là
A. ngoài cùng, dương
B. tự do, dương.
C. hóa trị, lưỡng cực.
D. hóa trị, âm.
Trong tinh thể kim loại. lực hút tĩnh điện giữa các ion dương ở nút mạng với các electron hóa trị chuyển động tự do tạo nên liên kết kim loại.
(1) tự do, (2) dương.
>> Các bạn có thể tham khảo chi tiết nội dung lí thuyết bài tập liên quan tại: Chuyên đề bài tập Đại cương kim loại