Bài tập tổng hợp Alcohol - Phenol
Các dạng bài tập Dẫn xuất halogen - Alcohol - Phenol
VnDoc.com xin gửi tới bạn đọc bài viết Bài tập tổng hợp Alcohol - Phenol để bạn đọc cùng tham khảo và có thêm tài liệu học tập. Mời các bạn cùng theo dõi bài viết dưới đây nhé.
A. BÀI DẪN XUẤT HALOGEN
I. Lí thuyết cần nắm
1. Khái niệm – Danh pháp
1.1. Khái niệm
Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng nguyên tử halogen, được dẫn xuất halogen của hydrocarbon.
Công thức tổng quát của dẫn xuất halogen: RXn.
Trong đó:
R: gốc hydrocarbon.
X: F, Cl, Br, I.
n: số nguyên tử halogen.
Ví dụ:
CH3Cl; CH3Br; CH2Cl2; CH2=CH–Cl; C6H5Br,…
1.2. Danh pháp
* Danh pháp thay thế
|
Vị trí halogen - halogeno |
Tên hydrocarbon |
- Lưu ý:
+ Nếu halogen chỉ có một vị trí duy nhất thì không cần số chỉ vị trí halogen.
+ Mạch carbon được ưu tiên đánh số từ phía gần nhóm thế hơn (từ nguyên tử halogen hoặc từ nhánh alkyl).
+ Nếu có liên kết bội thì ưu tiên đánh số từ phía gần liên kết bội.
+ Nếu có nhiều nguyên tử halogen thì cần thêm độ bội (di, tri, tetra …) trước “halogeno”.
- Ví dụ:
+ CH3Br : bromomethane.
+ CH3CH(Cl)CH2CH3 : 2-chlorobutane.
+ CH2=CHCH2F : 3-fluoroprop-1-ene.
+ CH2Cl – CH2Cl : 1,2-dichloroethane.
* Tên thông thường – Tên gốc chức
|
Tên thông thường |
|
|
CHCl3 |
Chloroform |
|
CHBr3 |
Bromoform |
|
CHI3 |
Iodoform |
|
CCl4 |
Carbon tetrachloride |
|
Tên gốc chức (Tên gốc hydrocarbon + halide) |
|
|
CH3 – CH2Cl |
Ethyl chloride |
|
CH2=CHCl |
Vinyl chloride |
|
C6H5I |
Phenyl iodide |
|
C6H2CH2Br |
Benzyl bromide |
|
CH3CH(Br)CH3 |
Isopropyl bromide |
2. Tính chất vật lí
- Phân tử của dẫn xuất halogen phân cực nên chúng có nhiệt độ nóng chảy và nhiệt độ sôi cao hơn các hydrocarbon có phân tử khối tương đương.
- Các dẫn xuất halogen hầu như không tan trong nước, tan tốt trong các dung môi hữu cơ như hydrocarbon, ether....
3. Tính chất hóa học
Liên kết C−X phân cực về phía nguyên tử halogen nên phản ứng đặc trưng của dẫn xuất halogen là phản ứng thế nguyên tử halogen. Ngoài ra, dẫn xuất halogen còn tham gia phản ứng tách HX.
3.1. Phản ứng thế nguyên tử halogen
Phương trình hóa học
R – X + OH– ![]() R – OH (alcohol) + X–
R – OH (alcohol) + X–
(X: Cl, Br, I; X liên kết với nguyên tử carbon no).
Ví dụ: CH3CH2Br + NaOH (loãng) ![]() CH3CH2OH + NaBr
CH3CH2OH + NaBr
3.2. Phản ứng tách hydrogen halide
Phương trình hóa học
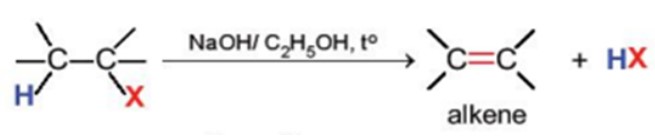
Phản ứng này xảy ra khi đun nóng dẫn xuất halogen với base mạnh như NaOH, RONa trong dung môi alcohol.
Ví dụ: CH3 – CH2Br ![]() CH2 =CH2 + HBr
CH2 =CH2 + HBr
Phản ứng tách xảy ra theo quy tắc tách Zaitsev: Trong phản ứng tách hydrogen halide, nguyên tử halogen bị tách ưu tiên cùng với nguyên tử hydrogen ở carbon bên cạnh có bậc cao hơn
Ví dụ: CH3CHBrCH2CH3 ![]() CH2 =CHCH2CH3 (spp) + CH3 CH=CHCH3 (spc)
CH2 =CHCH2CH3 (spp) + CH3 CH=CHCH3 (spc)
3.4. Ứng dụng
- Sản xuất vật liệu polymer;
- Sản xuất dược phẩm; dung môi.
- Tác nhân làm lạnh;
- Sản xuất thuốc bảo vệ thực vật; chất kich thích sinh trưởng.
II. Bài tập vận dụng phần tự luận
Câu 1: (SGK – KNTT) Gọi tên theo danh pháp thay thế các dẫn xuất halogen sau đây:
a) CH3CH2Br;
b) CH3CHICH3;
c) ; d) CH2=CHCl.
Câu 2: (SGK – KNTT) Viết công thức cấu tạo các dẫn xuất halogen có tên gọi sau đây:
a) iodoethane;
b) trichloromethane;
c) 2–bromopentane;
d) 2–chloro–3–methylbutane.
Câu 3: (SGK – CTST) Gọi tên các dẫn xuất halogen:
(1) CH3CH2CH2Cl;
(2) CH2=CHCl;
(3) ClCH2CH2CH2Cl;
4) CH3CH(CH3)CH2Cl;
Câu 4: (SGK – CTST) Viết công thức cấu tạo và gọi tên thay thế của các đồng phân dẫn xuất halogen có công thức phân tử C3H7Cl.
Câu 5: (SGK – Cánh Diều) Trong các đồng phân cấu tạo có cùng công thức phân tử là C4H9Cl, hãy chỉ ra đồng phân mạch carbon, đồng phân vị trí nhóm chức.
Câu 6: (SGK – Cánh Diều) Viết công thức cấu tạo và gọi tên thay thế của các hợp chất có cùng công thức phân tử là C5H11Cl.
Câu 7: (SBT – CTST)
- Các nhà hoá học đã tìm ra một số dẫn xuất halogen không chứa chlorine như: CF3CH2F, CF3CH2CF2CH3,... đang được sử dụng trong công nghiệp nhiệt lạnh, vì sự phân huỷ các hợp chất này nhanh chóng sau khi phát tán vào không khí nên ảnh hưởng rất ít đến tầng ozone hay sự ấm lên toàn cầu thấp. Gọi tên theo danh pháp thay thế 2 hợp chất đó.
- Vẽ công thức cấu tạo của hợp chất có tên: 4-chloro-3,4-dimethylpent-2-
- Viết đồng phân và gọi tên các dẫn xuất halogen bậc I của hợp chất có công thức C4H9
Câu 8: (SBT – CTST) So sánh nhiệt độ sôi của methane và các dẫn xuất halogen của methane: CH4, CH3Cl, CH2Cl2, CHCl3 và CCl4. Giải thích.
Câu 9: (SGK – Cánh Diều) Cho các chất có công thức: CH3F, CH3Cl, CH3Br, CH3I và nhiệt độ sôi của chúng (không theo thứ tự) là 42 oC, 4 oC, –24 oC và –78 oC. Hãy dự đoán nhiệt độ sôi tương ứng với mỗi chất trên. Giải thích.
Còn tiếp ...
B. ALCOHOL
I. Lí thuyết cần nắm
1. Khái niệm –Danh pháp
1.1.Khái niệm – Công thức chung
Alcohol là những hợp chất hữu cơ trong phân tử có chứa nhóm hydroxy (−OH) liên kết với nguyên tử carbon no.
|
|
Alcohol no, đơn chức, mạch hở |
Alcohol đa chức |
|
Khái niệm |
Alcohol no, đơn chức, mạch hở trong phân tử có một nhóm – OH liên kết với gốc alkyl. |
Alcohol có hai hay nhiều nhóm – OH được gọi là các alcohol đa chức (polyalcohol). |
|
Công thức chung |
CnH2n+1OH (n ≥ 1) |
|
|
Ví dụ |
CH3OH; C2H5OH,… |
C2H4(OH)2; C3H5(OH)3,…. |
Bậc alcohol là bậc của nguyên tử carbon liên kết với nhóm hydroxy. Do đó, ta có alcohol bậc I (C2H5OH,…), alcohol bậc II (CH3CHOHCH3,…) và alcohol bậc III ((CH3)3COH,…).
- Danh pháp
- Danh pháp thay thế monoalcohol
|
Tên hydrocarbon (bỏ e) |
Vị trí nhóm – OH |
ol |
Ví dụ: CH3CH(CH3)CH2OH : 2-methylbutan-1-ol CH3 – CH2OH : ethanol
- Danh pháp thay thế polyalcohol
|
Tên hydrocarbon |
Vị trí nhóm – OH |
độ bội nhóm – OH |
ol |
Ví dụ: CH2OH – CH2OH : ethane-1,2-diol CH2OH – CHOH – CH2OH : propane-1,2,3-triol
Lưu ý:
+ Nếu nhóm – OH chỉ có một vị trí duy nhất thì không cần số chỉ vị trí nhóm – OH.
+ Mạch carbon được ưu tiên đánh số từ phía gần nhóm – OH hơn.
+ Nếu mạch carbon có nhánh thì cần thêm tên nhánh ở phía trước.
+ Nếu có nhiều nhóm – OH thì cần thêm độ bội (di, tri, …) trước “ol” và giữ nguyên tên hydrocarbon.
- Danh pháp thường alcohol đơn chức
|
Tên gốc hydrocarbon |
alcohol |
Bảng: Tên theo danh pháp thay thế và danh pháp thường của 1 số alcohol
|
Công thức alcohol |
Danh pháp thay thế |
Danh pháp thường |
|
CH3OH |
Methanol |
Methyl alcohol |
|
CH3CH2OH |
Ethanol |
Ethyl alcohol |
|
CH3CH2CH2OH |
Propan-1-ol |
Propyl alcohol |
|
CH3CHOHCH3 |
Propan-1-ol |
Isopropyl alcohol |
|
CH2OH – CH2OH |
Ethane-1,2-diol |
Ethylene glycol |
|
CH2OH – CHOH – CH2OH |
Propane-1,2,3-triol |
Glycerol |
2.1.1. Tính chất vật lí
- Ở điều kiện thường, các alcohol no, đơn chức từ C1 đến C12 ở trạng thái lỏng, các alcohol từ C13 trở lên ở trạng thái rắn.
- Alcohol có nhiệt độ sôi cao hơn các hydrocarbon, dẫn xuất halogen có phân tử khối tương đương và dễ tan trong nước do các phân tử alcohol có thể tạo liên kết hydrogen với nhau và với nước.
- Khi số nguyên tử carbon trong phân tử tăng lên, độ tan trong nước của alcohol giảm nhanh do gốc hydrocarbon là phần kị nước tăng lên.
2. Tính chất hóa học
- Trong phân tử alcohol, các liên kết O–H và C–O đều phân cực về phía nguyên tử oxygen do oxygen có độ âm điện lớn hơn.
- Vì vậy, trong các phản ứng hoá học, alcohol thường bị phân cắt ở liên kết O–H hoặc liên kết C–O.
2.1. Phản ứng thế nguyên tử H của nhóm – OH.
Liên kết O – H phân cực nên trong một số phản ứng, nguyên tử hydrogen trong nhóm hydroxy có thể bị thay thế.
Alcohol phản ứng với các kim loại mạnh như sodium, potassium giải phóng khí hydrogen:
2R – OH + 2Na → 2RONa + H2
2.2. Phản ứng tạo ether
Khi đun nóng alcohol với H2SO4 đặc ở nhiệt độ thích hợp thì thu được ether.
Ví dụ:
2C2H5OH ![]() C2H5OC2H5 + H2O
C2H5OC2H5 + H2O
C2H5OC2H5: diethyl ether
⇒ Công thức tính số ether tạo thành từ n alcohol khác nhau là ![]()
3.3. Phản ứng tạo alkene
Khi cho hơi alcohol no, đơn chức, mạch hở đi qua bột Al2O3 nung nóng hoặc đun alcohol với H2SO4 đặc, H3PO4 đặc, alcohol bị tách nước tạo thành alkene:
Ví dụ:
CH3CH2OH ![]() CH2 = CH2 + H2O
CH2 = CH2 + H2O
Chú ý:
Phản ứng tách nước của alcohol tạo alkene ưu tiên theo quy tắc tách Zaitsev: Trong phản ứng tách nước của alcohol, nhóm – OH bị tách ưu tiên cùng với nguyên tử hydrogen ở carbon bên cạnh có bậc cao hơn.
3.4. Phản ứng oxi hoá
a) Oxi hoá không hoàn toàn
+ Các alcohol bậc I bị oxi hóa không hoàn toàn tạo thành aldehyde. Ví dụ:
CH3CH2OH + CuO ![]() CH3CHO + Cu + H2O
CH3CHO + Cu + H2O
Tổng quát:
R – CH2 – OH + CuO ![]() R – CHO + Cu + H2O
R – CHO + Cu + H2O
+ Các alcohol bậc II bị oxi hóa không hoàn toàn tạo thành ketone. Ví dụ:
CH3 - CH(OH) – CH3 + CuO ![]() CH3 – CO – CH3 + Cu + H2O
CH3 – CO – CH3 + Cu + H2O
Tổng quát:
R – CH(OH) – R’ + CuO![]() R – CO – R’ + Cu + H2O
R – CO – R’ + Cu + H2O
+ Trong điều kiện trên, alcohol bậc III không phản ứng.
b) Phản ứng cháy của alcohol
Các alcohol có thể bị đốt cháy trong không khí tạo thành carbon dioxide, hơi nước và toả nhiệt:
CnH2n + 2O + ![]() O2
O2 ![]() nCO2 + (n + 1)H2O
nCO2 + (n + 1)H2O
Ví dụ:
C2H5OH(l) + 3O2(g) ![]() 2CO2(g) + 3H2O(g)
2CO2(g) + 3H2O(g)
Ethanol được sử dụng phổ biến làm nhiên liệu cho đèn cồn, bếp cồn hoặc phối trộn với xăng để làm nhiên liệu cho động cơ đốt trong.
5. Phản ứng riêng của polyalcohol với Cu(OH)2
Các polyalcohol có các nhóm – OH liền kề như ethylene glycol, glycerol có thể tác dụng với copper(II) hydroxide tạo thành dung dịch màu xanh lam đậm.
Ví dụ:

Vì vậy, phản ứng này có thể dùng để nhận biết các polyalcohol có các nhóm – OH liền kề.
II. Bài tập vận dụng phần tự luận
Câu 1: (SBT – Cánh Diều) Hãy nối một chất ở cột A với một hoặc nhiều thông tin về phân loại alcohol ở cột B cho phù hợp.
|
Cột A |
Cột B |
|
a) CH3CH2OH |
1) Alcohol bậc một |
|
b) (CH3)3COH |
2) Alcohol bậc hai |
|
c) CH3CH=CHCH2OH |
3) Alcohol bậc ba |
|
d) CH3CH(OH)CH3 |
4) Alcohol no |
|
|
5) Alcohol không no |
Câu 2: (SBT – Cánh Diều) Điền các thông tin thích hợp vào ô trống để hoàn thành bảng mô tả về các đồng phân có công thức phân tử C3H8O sau:
|
Công thức cấu tạo |
..(1).. |
..(2).. |
..(3).. |
|
Tên gọi |
Ethyl methyl ether |
..(4).. |
..(5).. |
|
Loại nhóm chức |
Ether |
Alcohol bậc một |
Alcohol bậc hai |
|
Phản ứng với Na |
..(6).. |
..(7).. |
..(8).. |
|
Phản ứng với CuO, to |
..(9).. |
..(10).. |
..(11).. |
Câu 3: (SBT – Cánh Diều) Tìm thông tin thích hợp điền vào chỗ trống trong mỗi phát biểu sau.
- Propane-1,2,3-triol có tên thông thường là..(1)..
- Cho ethane-1,2-diol vào ống nghiệm có Cu(OH)2 và dung dịch NaOH, lắc nhẹ, hiện tượng quan sát được là..(2)..
- Đun nóng hỗn hợp gồm ethanol, methanol và H2SO4 thu được tối đa..(3).. ether có công thức cấu tạo là..(4)..
- Cho a mol alcohol R(OH)n phản ứng với Na (dư), thu được tối đa a mol khí H2. Giá trị của n là..(5)..
Chi tiết câu hỏi, đáp án tài liệu nằm trong FILE TẢI VỀ
.............................











