Tính pH của dung dịch axit – bazơ yếu
Chuyên đề Hóa học lớp 11: Tính pH của dung dịch axit – bazơ yếu được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 11 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Tính pH của dung dịch axit – bazơ yếu
I. Phương pháp giải
Tương tự như axit mạnh.
Sử dụng kết hợp công thức tính độ điện li α, hằng số điện li axit, bazo: Ka, Kb
- Độ điện li α của chất điện li là tỉ số giữa số phân tử phân li ra ion (n) và tổng số phân tử hòa tan (no)
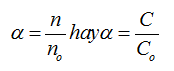
- Hằng số phân li axit: HA ⇌ H+ + A-
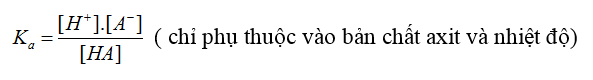
- Hằng số phân li bazơ: BOH ⇌ B+ + OH-
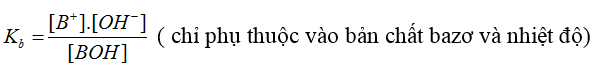
II. Ví dụ
Bài 1: Hoà tan 1,07g NH4Cl vào nước được 2 lít dung dịch X.
a. Tính pH của dung dịch X biết hằng số phân li bazơ của NH3 là 1,8.10-5.
b. Nếu thêm vào dung dịch X 100 ml dd HCl 0,01M được dd Y. Tính pH của dd Y?
Trả lời
a. nNH4Cl = 1,07/53,5 = 0,02 => CM(NH4Cl) = 0,02/2 = 0,01 M
Phương trình điện li:
NH4Cl → NH4+ + Cl-
NH4+ + H2O ⇌ NH3 + H3O+
Ban đầu 0,01
Điện ly: x x x
Sau điện li: 0,01-x x x
Kb = x2/(0,01-x) = 1,8.10-5 => x = 4,24.10-4 => pH = 3,37
b. Phương trình điện li:
HCl → H+ + Cl+
NH4+ + H2O ⇌ NH3 + H3O+
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 11: Tính pH của dung dịch axit – bazơ yếu. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 11, Giải bài tập Hóa học lớp 11, Giải bài tập Vật Lí 11, Tài liệu học tập lớp 11 mà VnDoc tổng hợp và đăng tải.









