Photpho - Axit photphoric - Muối photphonat
Chuyên đề Hóa học lớp 11: Photpho - Axit photphoric - Muối photphonat được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 11 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Photpho - Axit photphoric - Muối photphonat
I. Photpho
1. Tính chất hóa học
a) Tính oxi hoá: tác dụng với một số kim loại hoạt động, tạo ra photphua kim loại.
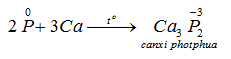
b) Tính khử: tác dụng với các phi kim hoạt động như oxi, halozen, lưu huỳnh ... cũng như với các chất oxi hóa mạnh khác
→ Tác dụng với oxi: Khi đốt nóng, photpho cháy trong không khí tạo ra các oxit của photpho:
Thiếu oxi:
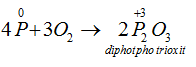
Dư Oxi:
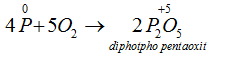
→ Tác dụng với clo: Khi cho clo đi qua P nóng chảy, sẽ thu được các hợp chất photpho clorua:
Thiếu clo:
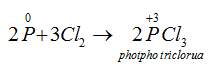
Dư clo:
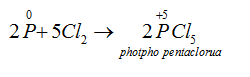
→ Tác dụng với hợp chất:
6P + 5KClO3 → 3P2O5 + 5KCl
2. Điều chế: Trong công nghiệp, photpho được sản xuất bằng cách nung hỗn hợp quặng photphorit, cát và than cốc khoảng 1200oC trong lò điện:
Ca3(PO4)2 + 3SiO2 + 5C to→ 3CaSiO3 + 2P + 5CO (3CaO. P2O5)
Hơi photpho thoát ra được ngưng tụ khi làm lạnh, thu được photpho trắng ở dạng rắn
II. Axit photphoric
Công thức cấu tạo:
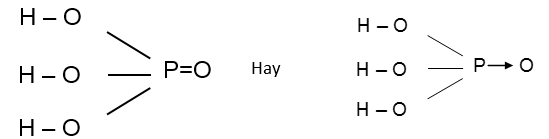
1. Tính chất vật lí: Là chất rắn dạng tinh thể trong suốt, không màu, nóng chảy ở 42,5oC. dễ chảy rữa và tan vô hạn trong nước.
2. Tính chất hóa học:
a) Tính oxi hóa – khử:
Axít photphoric khó bị khử (do P ở mức oxi hóa +5 bền hơn so với N trong axit nitric), không có tính oxi hóa.
b) Tính axit: Axít photphoric là axit có 3 lần axit, có độ mạnh trung bình. Trong dung dịch nó phân li ra 3 nấc:
H3PO4 ⇌ H+ + H2PO4- k1 = 7, 6.10-3
H2PO4- ⇌ H+ + HPO42- k2 = 6,2.10-8 nấc 1 > nấc 2 > nấc 3
HPO42- ⇌ H+ + PO43- k3 = 4,4.10-13
→ Dung dịch axít photphoric có những tính chất chung của axit như làm quì tím hóa đỏ, tác dụng với oxit bazơ, bazơ, muối, kim loại.
→ Khi tác dụng với oxit bazơ, bazơ tùy theo lượng chất tác dụng mà axít photphoric tạo ra muối trung hòa, muối axit hoặc hỗn hợp muối:
H3PO4 + NaOH → NaH2PO4 + H2O
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
H3PO4 + 3NaOH → Na3PO4 + 3H2O
3. Điều chế:
a) Trong phòng thí nghiệm: P + 5HNO3 →H3PO4 + H2O + 5NO2
b) Trong công nghiệp:
+ Cho H2SO4 đặc tác dụng với quặng photphorit hoặc quặng apatit: Ca3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
Điều chế bằng phương pháp này không tinh khiết và lượng chất thấp
+ Để điều chế H3PO4 có độ tinh khiết và nồng độ cao hơn người ta đốt cháy P để được P2O5 rồi cho P2O5 tác dụng với nước:
4P + 5O2 → 2P2O5
P2O5 + 3H2O → 2H3PO4
III. Muối photphat
Axít photphoric tạo ra 3 loại muối:
- Muối photphat trung hòa: Na3PO4, Ca3(PO4)2, ...
- Muối đihidrophotphat: NaH2PO4, Ca(H2PO4)2, ...
- Muối hidrophotphat: Na2HPO4, CaHPO4 ...
1. Tính tan: Tất cả các muối đihidrophotphat đều tan trong nước.Các muối hidrophotphat và photphat trung hòa đều không tan hoặc ít tan trong nước (trừ muối natri, kali, amoni).
2. Nhận biết ion photphat: Thuốc thử là bạc nitrat.
3Ag+ + PO43- → Ag3PO4 ↓ (màu vàng)
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 11: Photpho - Axit photphoric - Muối photphonat. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 11, Giải bài tập Hóa học lớp 11, Giải bài tập Vật Lí 11, Tài liệu học tập lớp 11 mà VnDoc tổng hợp và đăng tải.









