Anken
Chuyên đề Hóa học lớp 11: Anken được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 11 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Anken
I. Đồng đẳng, đồng phân, danh pháp
1. Dãy đồng đẳng
- CTTQ chung của dãy đồng đẳng anken là: CnH2n (n ≥ 2)
2. Danh pháp
* Tên thông thường: Tên ankan – an + ilen
Ví dụ: CH2=CH2 etilen ; CH2=CH–CH3 Propilen
* Tên thay thế: gọi tên theo cách sau
- Chọn mạch chính là mạch C dài nhất có chứa lk đôi
- Đánh số C mạch chính từ phía gần lk đôi hơn .
Gọi tên : vị trí nhánh – tên nhánh – tên C mạch chính – vị trí liên kết đôi – en
CH2=CH-CH2-CH3 But –1– en CH3-CH=CH-CH3 But –2–en
3. Đồng phân
a) Đồng phân cấu tạo
- Đồng phân vị trí lk đôi: CH2=CH-CH2-CH3 CH3-CH=CH-CH3
- Đồng phân mạch cacbon:

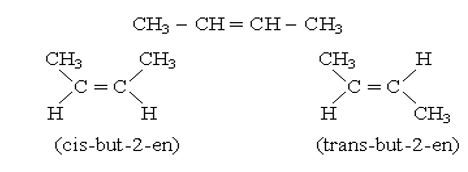
b) đồng phân hình học:
Ví dụ: But-2-en
II. Tính chất hóa học
1. Phản ứng cộng hiđrô (Phản ứng hiđro hoá)
CH2=CH2 + H2 → CH3-CH3
2. Phản ứng cộng halogen (Phản ứng halogen hoá)
CH2=CH2 + Br2 → Br – CH2 – CH2– Br
-Anken làm mất màu của dung dịch brom → Phản ứng này dùng để nhận biết anken .
3. Phản ứng cộng nước và axit
a) cộng axit HX
CH2=CH2 + HCl → CH3CH2Cl
- Đối với các anken khác, nguyên tử halogen (trong HX) mang điện âm, ưu tiên đính vào nguyên tử C bậc cao (theo quy tắc Maccopnhicop).
* Quy tắc Maccopnhicop: Trong phản ứng cộng HX (axit hoặc nước) vào lk C=C của anken , H (phần mang điện tích dương) cộng vào C mang nhiều H hơn , X- (hay phần mang điện tích âm) cộng vào C mang ít H hơn.
b) cộng nước:
CH2=CH2 + H-OH to→ HCH2 – CH2OH
4. Phản ứng trùng hợp:
nCH2=CH2 → [- CH2 – CH2- ]n
-Phản ứng trùng hợp là quá trình cộng hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành phân tử lớn gọi là polime.
-Số lượng mắc xích trong một phân tử polime gọi là hệ số trùng hợp, kí hiệu n
5. Phản ứng oxi hoá
a) Oxi hoá hoàn toàn: CnH2n + 3n/2O2 to→ nCO2+ nH2O
Nhận xét: đốt anken thu nCO2 = nH2O
b) Oxi hoá không hoàn toàn:
3CH2 = CH2 + 4H2O + 2KMnO4 → 3HO – CH2 – CH2 – OH + 2MnO2 + 2KOH
Anken làm mất màu dd KMnO4 → Dùng để nhận biết anken.
III. Điều chế
Trong phòng thí nghiệm: CH3CH2OH → CH2=CH2 + H2O (170oC)
Trong công nghiệp: CnH2n+2 to→ CaH2a+2 + CbH2b (với n = a +b)
C4H10 to→ C2H4 + C2H6
Với chuyên đề Anken chúng ta có thể nắm rõ cấu tạo, các danh pháp, đồng đẳng đồng phân và cách điều chế Anken
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 11: Anken. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 11, Giải bài tập Hóa học lớp 11, Giải bài tập Vật Lí 11, Tài liệu học tập lớp 11 mà VnDoc tổng hợp và đăng tải.









