Hóa học 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
Lý thuyết Hóa học 11 Bài 35
Hóa học 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác được VnDoc.com tổng hợp và xin gửi tới bạn đọc. Mời các bạn cùng tham khảo chi tiết.
A - BENZEN VÀ ĐỒNG ĐẲNG
I- ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP, CẤU TẠO
1. Dãy đồng đẳng của benzen
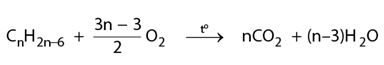
Benzen C6H6 và các hiđrocacbon thơm khác có công thức phân tử là C7H8 (toluen), C8H10, lập thành dãy đổng đẳng có công thức phân tử chung CnH2n−6 ( n ≥ 6 )
2. Đồng phân, danh pháp
Một số hiđrocacbon thơm đầu dãy đồng đẳng có công thức cấu tạo và tên gọi được trình bày trong bảng 7.1.
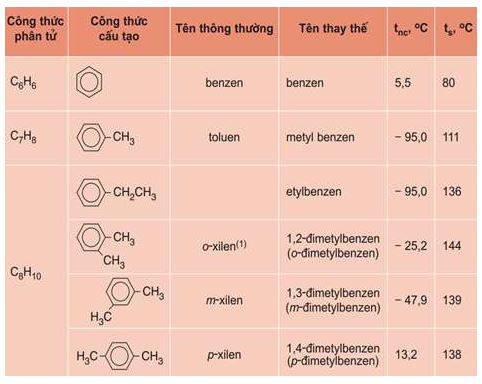
Từ C8H10 trở đi có các đổng phân về vị trí tương đối của các nhóm ankyl xung quanh vòng benzen và về cấu tạo mạch cacbon của mạch nhánh.
Tên hệ thống của các đổng đẳng của benzen được gọi bằng cách gọi tên các nhóm ankyl+ benzen.
3. Cấu tạo
Để thể hiện cấu tạo của benzen, ngày nay người ta dùng một trong hai công thức cấu tạo sau.

II. TÍNH CHẤT VẬT LÍ
Các hiđrocacbon thơm đều là chất lỏng hoặc rắn ở điều kiện thường, chúng có nhiệt độ sôi tăng theo chiều tăng của phân tử khối.
Các hiđrocacbon thơm ở thể lỏng có mùi đặc trưng, không tan trong nước và nhẹ hơn nước, có khả năng hoà tan nhiều chất hữu cơ.
III. TÍNH CHẤT HOÁ HỌC
1. Phản ứng thế
a) Thế nguyên tử H của vòng benzen
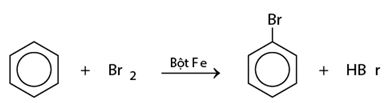
* Phản ứng với halogen
Cho benzen và brom vào ống nghiệm khô rồi lắc nhẹ hỗn hợp.
Cho tiếp một ít bột sắt vào ống nghiệm trên, lắc nhẹ. Màu của brom nhạt dần và thấy có khí hiđro bromua thoát ra do đã xảy ra phản ứng thế:
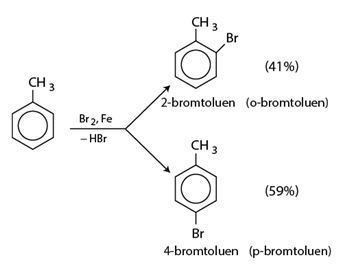
Nếu cho các ankylbenzen phản ứng với brom trong điều kiện có bột sắt sẽ thu được hỗn hợp sản phẩm thế brom chủ yếu vào vị trí para và ortho so với nhóm ankyl:
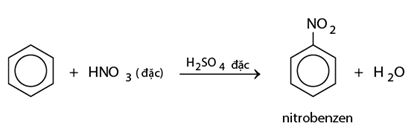
* Phản ứng với axit nitric
Cho benzen vào ống nghiệm chứa sẵn hỗn hợp H2SO4 đặc và HNO3 đặc. Khi đó sẽ thấy có lớp chất lỏng nặng màu vàng nhạt lắng xuống. Đó là nitrobenzen được tạo thành theo phản ứng:
*Quy tắc thế: Các ankylbenzen dễ tham gia phản ứng thế' nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl.
b) Thế nguyên tử H của mạch nhánh
Nếu đun toluen hoặc các ankylbenzen với brom, sẽ xảy ra phản ứng thế nguyên tử H của mạch nhánh tương tự ankan.
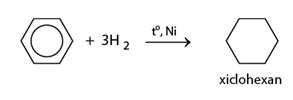
2. Phản ứng cộng
a) Cộng hiđro
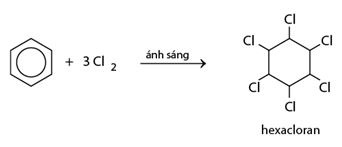
b) Cộng clo
Dẫn lượng nhỏ khí clo vào bình chứa một ít benzen, đậy kín lại rồi đưa bình ra ngoài ánh nắng. Trong bình xuất hiện khói trắng và thành bình xuất hiện một lớp bột màu trắng. Đó là 1,2,3,4,5,6-hexacloxiclohexan (hexacloran).
3. Phản ứng oxi hoá
a) Phản ứng oxi hoá không hoàn toàn
Thí nghiệm:
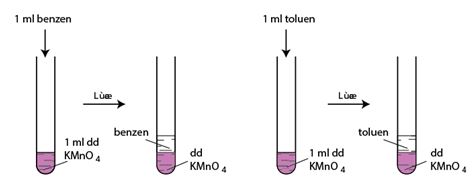
Khi đun nóng đồng thời cả hai ống nghiệm trong nồi cách thuỷ:
- Benzen vân không làm mất màu dung dịch kali pemanganat.
- Toluen làm mất màu dung dịch kali pemanganat, tạo kết tủa mangan đioxit.
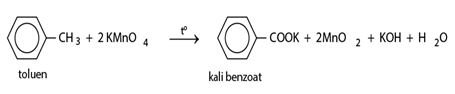
b) Phản ứng oxi hoá hoàn toàn
Các hiđrocacbon thơm khi cháy toả nhiều nhiệt:

B - MỘT VÀI HIĐROCACBON THƠM KHÁC
I. STIREN
1. Cấu tạo và tính chất vật lí
Công thức phân tử: C8H8
Công thức cấu tạo:
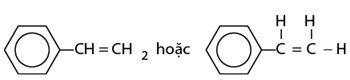
Stiren (còn gọi là vinylbenzen) là chất lỏng không màu, sôi ở 146oC, tan nhiều trong dung môi hữu cơ.
2. Tính chất hoá học
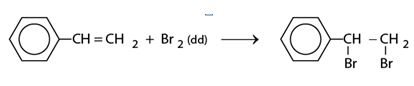
a) Phản ứng với dung dịch brom
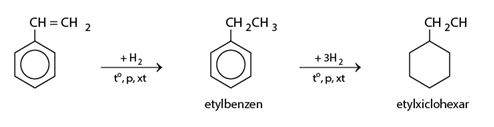
b) Phản ứng với hiđro
Khi cho stiren tác dụng với hiđro dư có xúc tác ở nhiệt độ và áp suất cao sẽ thu được etylxiclohexan:
c) Phản ứng trùng hợp
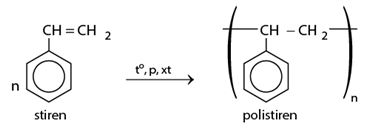
II. NAPHTALEN
1. Cấu tạo và tính chất vật lí
Công thức phân tử: C10H8
Công thức cấu tạo:
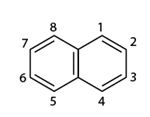
Naphtalen (băng phiến) là chất rắn, nóng chảy ở 80oC, tan trong benzen, ete,... và có tính thăng hoa.
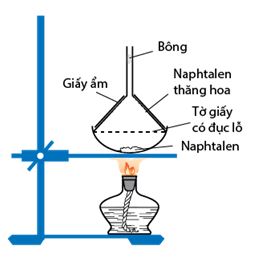
2. Tính chất hoá học
a) Phản ứng thế
Naphtalen tham gia phản ứng thế tương tự benzen, nhưng phản ứng xảy ra dễ dàng hơn và thường ưu tiên thế vào vị trí số 1.
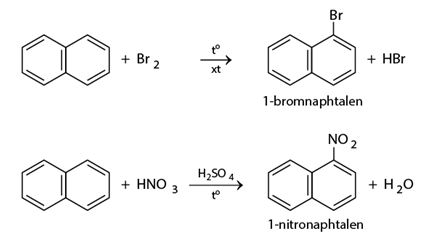
b) Phản ứng cộng
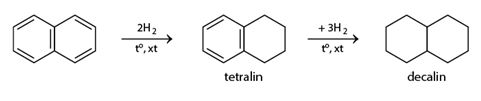
Khi có chất xúc tác, naphtalen cộng hiđro tạo ra đecalin:
C - ỨNG DỤNG CỦA MỘT số HIĐROCACBON THƠM
Benzen và toluen là nguyên liệu rất quan trọng cho công nghiệp hoá học. Nguồn cung cấp benzen, toluen chủ yếu là từ nhựa than đá và từ sản phẩm đề hiđro đóng vòng hexan, heptan tương ứng.
Trên đây VnDoc.com vừa gửi tới bạn đọc bài viết Hóa học 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác. Hi vọng qua bài viết này bạn đọc có thêm tài liệu học tập môn Hóa học 11. Mời các bạn cùng tham khảo thêm Lý thuyết Hóa học 11...