Hóa 11 bài 1: Sự điện li
Sự điện li Hóa 11
Hóa 11 bài 1: Sự điện li được VnDoc biên soạn tổng hợp nội dung kiến thức trọng tâm Bài 1 Sự điện li, hy vọng với nội dung tài liệu rõ ràng, giúp các bạn nắm được các khái niệm nội dung chính trong bài Hoá 11 Bài 1, cũng như biết các vận dụng vào các dạng bài tập hóa 11 bài 1. Mời các bạn tham khảo.
>> Bài tiếp theo:
A. Tóm tắt lý thuyết Hóa 11 bài 1
I. Hiện tượng điện li
1. Thí nghiệm
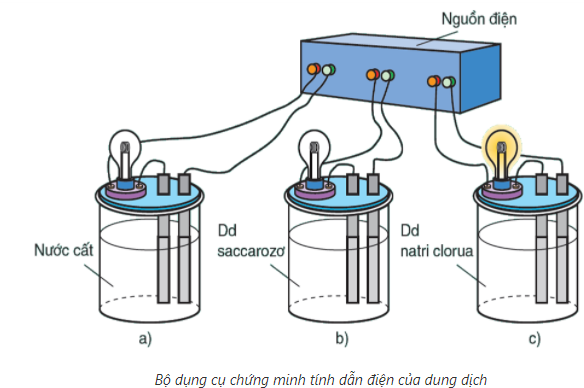
Khi nối các đầu dây dẫn điện với cùng một nguồn điện, ta chỉ thấy bóng đèn ở cốc đựng dung dịch NaCl bật sáng. Vậy dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozơ không dẫn điện.
Nếu làm các thí nghiệm tương tự, người ta thấy: NaCl rắn, khan; NaOH rắn, khan; các dung dịch ancol etylic (C2H5OH), glixerol (C2H5(OH)3)không dẫn điện.
Ngược lại, các dung dịch axit, bazơ và muối đều dẫn điện.
2. Nguyên nhân tính dẫn điện của các dung dịch axit, bazơ và muối trong nước
Ngay từ năm 1887, A-rê-ni-ut (S.Arrhenius) đã giả thiết và sau này thực nghiệm đã xác nhận rằng:
Tính dẫn điện của các dung dịch axit, bazơ và muối là do trong dung dịch của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi là các ion.
Quá trình phân li các chất trong nước ra ion là sự điện li. Những chất tan trong nước phân li ra ion được gọi là những chất điện li .
Vậy axit, bazơ và muối là những chất điện li.
Sự điện li được biểu diễn bằng phương trình điện li.
Ví dụ:
- Muối phân li thành cation kim loại và anion gốc axit:
NaCl → Na+ + Cl-
- Axit phân li thành cation H+ và anion gốc axit:
HCl → H+ + Cl-
Bazơ phân li thành cation kim loại và anion hiđroxit:
NaOH → Na+ + OH-
3. Định nghĩa sự điện li
- Sự điện li là quá trình phân li thành các ion (cation, anion) khi chất tan vào nước hoặc nóng chảy.
- Chất điện li là những chất khi tan vào nước tạo thành dung dịch dẫn điện nhờ phân li thành ion.
II. Phân loại các chất điện li
1. Độ điện li
Để biểu thị mức độ phân li ra ion của các chất điện li, ta dùng khái niệm độ điện li.
- Độ điện li α (anpha) của một chất điện li là tỉ số giữa phân tử phân li thành ion (n) và tổng số phần tử hòa tan (n0).
![]() \(\alpha\;=\frac{n\;}{n_0}\)
\(\alpha\;=\frac{n\;}{n_0}\)
- Tỉ lệ phân tử cũng là tỉ lệ với số mol, nên α bằng tỉ số phần nồng độ mol chất tan phân li thành Cp và tổng nồng độ mol của chất tan trong dung dịch Ct:
![]() \(\alpha=\frac{C_p}{C_t}\)
\(\alpha=\frac{C_p}{C_t}\)
- Độ điện li α phụ thuộc vào:
Bản chất của chất tan.
Bản chất của dung môi.
Nhiệt độ
Nồng độ chất điện li.
2. Chất điện li mạnh và chất điện li yếu
a) Chất điện li mạnh
Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion, α=1.
Những chất điện li mạnh là các axit mạnh như HCl, HNO3, HClO4, H2SO4, ...; các bazơ mạnh như NaOH, KOH, Ba(OH)2,... và hầu hết các muối.
Trong phương trình điện li của chất điện li mạnh, người ta dùng một mũi tên chỉ chiều của quá trình điện li.
Ví dụ:
Na2SO4 → 2Na+ + SO42−
b) Chất điện li yếu
Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Những chất điện li yếu là các axit yếu như CH3COOH, HClO, H2S, HF, H2SO3, ... ;các bazơ yếu như Bi(OH)3, Mg(OH)2, ...
Trong phương trình điện li của chất điện li yếu, người ta dùng hai mũi tên ngược chiều nhau.
Ví dụ:
CH3COOH ⇄ CH3COO−+ H+
Cân bằng điện li là cân bằng động. Giống như mọi cân bằng hoá học khác, cân bằng điện li cũng tuân theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê.
B. Giải bài tập hóa 11 bài 1
Để giúp bạn đọc nâng cao củng cố kiến thức bài học, cũng như rèn luyện kĩ năng thao giải bài tập điện li, VnDoc đã biên soạn hướng dẫn bạn đọc giải bài tập sách giáo khoa Hóa 11 bài 1 tại:
C. Bài tập luyện tập
D. Câu hỏi trắc nghiệm bài tập điện li
Câu 1. Nhóm các chất nào dưới đây chỉ gồm các chất điện li mạnh
A. BaCl2; CuSO4; H2SO4; H2S.
B. HNO3; Ca(NO3)2; CaCl2; H3PO4 .
C. KCl; NaOH; Ba(NO3)2; Na2SO4.
D. HCl; CaCl2; NH3; CH3COOH
Câu 2. Dung dịch chất nào sau không dẫn điện?
A. C2H5OH
B. NaCl
C. NaHCO3.
D. CuSO4
Câu 3. Cho dãy các chất: KAl(SO4)2.12H2O, C2H5OH, C6H12O6, CH3COOH, Ca(OH)2, CH3COONH4. Số chất điện li là:
A. 3
B. 4
C. 5
D. 2
Câu 4. Cho các chất dưới đây: H2O, HCl, NaOH, NaCl, CH3COOH, CuSO4, HgCl2, Al(OH)3. Các chất điện li yếu là:
A. H2O, NaCl, CH3COOH, Al(OH)3
B. Al(OH)3, CH3COOH, H2O, NaOH.
C. H2O, CH3COOH, Al(OH)3, HgCl2
D. H2O, CH3COOH, CuSO4, HgCl2
Câu 5. Phương trình điện li nào sau đây viết đúng?
A. HCl → H+ + Cl−
B. H2CO3 ⇌ 2H+ + HCO3-
C. H2SO3 → 2H+ + SO32-
D. Na2S ⇌ 2Na+ + S2-
Câu 6. Cho các chất: NaOH, Na2CO3, Ca(OH)2, CH3COONa, C2H5OH,C2H5ONa, HCl, H2SO4, BaCl2, Số các chất khi cho thêm nước tạo thành dd dẫn điện là:
A. 11
B. 8
C. 9
D. 10
Câu 7. Trong số các chất sau: HNO2, CH3COOH, KMnO4, C6H6, HCOOH, HCOOCH3, C6H12O6, C2H5OH, SO2, Cl2, NaClO, CH4, NaOH, H2S. Số chất thuộc loại chất điện li là
A. 8.
B. 7.
C. 9.
D. 10.
Câu 8. Vì sao dung dịch của các dung dịch axit, bazơ, muối dẫn được điện?
A. Do axit, bazơ, muối có khả năng phân li ra ion trong dung dịch.
B. Do các ion hợp phần có khả năng dẫn điện.
C. Do có sự di chuyển của electron tạo thành dòng electron.
D. Do phân tử của chúng dẫn được điện.
Câu 9. Chất nào sau đây không dẫn điện được?
A. KCl rắn, khan.
B. CaCl2 nóng chảy.
C. NaOH nóng chảy.
D. HBr hòa tan trong nước.
Câu 10. Dung dịch nào dưới đây có khả năng dẫn điện?
A. Dung dịch đường.
B. Dung dịch muối ăn.
C. Dung dịch ancol.
D. Dung dịch benzen trong ancol.
Đáp án câu hỏi trắc nghiệm
| 1. C | 2. A | 3. B | 4. C | 5. A |
| 6. B | 7. B | 8. A | 9. A | 10. B |
--------------------
>> Mời các bạn tham khảo thêm một số nội dung liên quan:
- Hóa 11 Bài 3: Sự điện li của nước. pH. Chất chỉ thị Axit - Bazơ
- Giải bài tập Hóa 11 bài 3: Sự điện li của nước. pH. Chất chỉ thị axit - bazơ
- Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
- Giải bài tập hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Hy vọng với nội dung lý thuyết tài liệu, sẽ giúp bạn đọc củng cố nâng cao kiến thức bài học Hóa học 11 Bài 1: Sự điện li. Cũng như đưa ra các nội dung câu hỏi bài tập có liên quan đến nội dung lý thuyết Sự điện li.
Trên đây VnDoc.com vừa giới thiệu tới các bạn bài viết Hóa 11 bài 1: Sự điện li, mong rằng qua bài viết này các bạn có thể học tập tốt hơn môn Hóa học lớp 11. Mời các bạn cùng tham khảo thêm kiến thức các môn Toán 11, Ngữ văn 11, Tiếng Anh 11, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11...
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, VnDoc mời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.









