Bài tập tự luận môn Hóa học lớp 11 - Đại cương về hóa học hữu cơ
Bài tập tự luận môn Hóa học lớp 11 - Chương 4: Đại cương về hóa học hữu cơ
Bài tập tự luận môn Hóa học lớp 11 - Chương 4: Đại cương về hóa học hữu cơ tổng hợp các công thức cần nhớ và các dạng bài tập cơ bản về hóa hữu cơ lớp 11, như xác định công thức phân tử hợp chất hữu cơ, xác định khối lượng mỗi nguyên tố trong hợp chất hữu cơ...
A. Công thức cần nhớ hóa hữu cơ
I. Xác định thành phần nguyên tố (m, %)
1. Xác định khối lượng các nguyên tố có trong mA gam hợp chất:
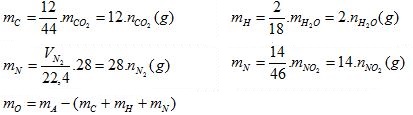
2. Xác định % khối lượng các nguyên tố có trong mA gam hợp chất:
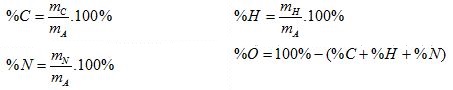
II. Xác định khối lượng phân tử của chất hữu cơ (MA)
1. Trường hợp cho tỷ khối hơi:
![]()
2. Trường hợp cho thể tích phân tử gam:
![]()
* Chú ý: Theo Định luật Avôgadrô: Hai chất khác nhau ở cùng điều kiện nhiệt độ và áp suất, chiếm cùng thể tích chúng phải có cùng số mol.
![]()
III. Xác định công thức phân tử (CxHyOzNt)
1. Dựa vào công thức ĐGN mà xác định
![]()
2. Dựa vào thành phần nguyên tố mà xác định
![]()
3. Dựa vào phương trình phản ứng đốt cháy
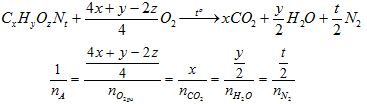
- Nếu đề bài cho đầy đủ các tỉ lệ trên ta xác định được cụ thể các giá trị của x, y, z, t
→ Xác định công thức phân tử
- Nếu đề bài cho thiếu một trong các tỉ lệ trên ta chỉ xác định được tỉ lệ của x:y:z:t
→ Chỉ xác định được công thức ĐGN.
B. Bài tập hóa hữu cơ 11
Dạng 1: Xác định % khối lượng mỗi nguyên tố trong hợp chất hữu cơ
Bài 1. Đốt cháy hoàn toàn 0,92 gam hợp chất hữu cơ thu được 1,76 gam CO2 và 1,08 gam H2O. Xác định % khối lượng mỗi nguyên tố trong hợp chất hữu cơ.
Đáp án hướng dẫn giải chi tiết
Bảo toàn nguyên tố "C": nC = nCO2 = 1,76/44 = 0,04 mol
Bảo toàn nguyên tố "H": nH = 2.nH2O = 2.(1,08/18) = 0,12 mol
Bảo toàn khối lượng => mO = mX - mC - mH = 0,92 - 12.0,04 - 0,12 = 0,32 gam
=> %mO = (0,32/0,92).100% = 34,78%
%C = 0,48/0,92 = 52,17%
%H = 0,12 /0,92 =13,04%
Bài 2. Đốt cháy hoàn toàn 7,75 g vitamin C (chứa C, H, O) thu được 11,62 g CO2 và 3,17 g H2O. Xác định % khối lượng mỗi nguyên tố trong phân tử vitamin C.
Đáp án hướng dẫn giải chi tiết
nCO2 =11,62/44 =0,264 mol → nC = 0,264mol
nH2O =3,17/18 = 0,176 mol → nH = 0,352mol
%mC = 0,264.12/7,75.100% = 40,88%
%mH = 0,352/7,75.100% = 4,54%%
mO= 100% − 4,54% − 40,88% = 54,58%
Bài 3. Oxi hoá hoàn toàn 0,6 g hợp chất hữu cơ A thu được 0,7437 lít khí CO2 (ở đkc) và 0,72 g H2O. Tính thành phần phần trăm của các nguyên tố trong phân tử chất A.
Đáp án hướng dẫn giải chi tiết
nCO2 = 0,7437/24,79 = 0,03 mol
nH2O = 0,72/18 = 0,04 mol
nC = nCO2 = 0,03 mol
nH = 2nH2O = 0,08 mol
%m = 0,03.120,6.100% = 60%
%mH = 0,08.10,6.100% = 13,33%
%mO = 100 − 60 −13,33 = 26,67%
Bài 4. Oxi hoá hoàn toàn 0,135 g hợp chất hữu cơ A rồi cho sản phẩm lần lượt qua bình 1 chứa H2SO4 đặc và bình 2 chứa KOH, thì thấy khối lượng bình 1 tăng lên 0,117 g, bình 2 tăng thêm 0,396 g. Ở thí nghiệm khác, khi nung 1,35 g hợp chất A với CuO thì thu được123,95 ml (đkc) khí nitrogen. Tính thành phần phần trăm của các nguyên tố trong phân tử chất A.
Đáp án hướng dẫn giải chi tiết
Do khi oxi hóa và khi đốt có CO2, H2O và N2
=> Hợp chất hữu cơ A phải có các nguyên tố C, H, N và có thể có O
=> mbình1tăng = mH2O = 0,117(g)
=> nH2O = 0,117/18 = 0,0065 (mol)
=>nH = 2nH2O = 2.0,0065 = 0,013 (mol)
=>mbình2tăng = mCO2 = 0,39 6 (g)
=> nCO2 = 0,396/44 = 0,009 (mol) => nC = nCO2 = 0,009 (mol)
nN2 = 123,95/1000.24,79 = 0,0005 (mol) =>nN = 2nN2 = 0,0005.2 = 0,001 (mol)
=> mA = mC + mH + mN = 0,009.12 + 0,013.1+ 0,001.14 = 0,135 (g)
=> A không có Oxygen
=> Đặt công thức hóa học: CxHyNz
=> x:y:z = 0,009:0,013:0,001 = 9:13:1
=> CTHH : C9H13N
Bài 5. Oxi hoá hoàn toàn 0,46 g hợp chất hữu cơ A, dẫn sản phẩm lần lượt qua bình 1 chứa H2SO4 đặc và bình 2 chứa KOH dư thấy khối lượng bình 1 tăng 0,54 g bình 2 tăng 0,88 g. Tính thành phần phần trăm của các nguyên tố trong phân tử chất A.
Đáp án hướng dẫn giải chi tiết
A + O2 ![]() CO2 + H2O
CO2 + H2O
Bình 1 tăng là do H2O bị giữ lại.
→ mH2O = 0,54 gam
→ nH2O= 0,54/18 = 0,03 mol
Bình 2 là do CO2 phản ứng bị giữ lại
→ mCO2 = 0,88 gam
→ nCO2 = 0,88/44 = 0,02 mol
→ nC = nCO2 = 0,02 mol
nH = 2nH2O= 0,06 mol
→ mC= 0,02.12 = 0,24 gam
mH =0,06.1= 0,06 gam
→%mC= 0,24/0,46 .100 = 52,174%
%mH=0,06/0,46 .100 =13,04%
→%mO =100%− 52,174% − 13,04% = 34,786%
Bài 6. A là một chất hữu cơ chỉ chứa 2 nguyên tố. Khi oxi hoá hoàn toàn 2,50 g chất A người ta thấy tạo thành 3,60 g H2O. Xác định thành phần định tính và định lượng của chất A.
Bài 7. Khi oxi hoá hoàn toàn 5,00 g một chất hữu cơ, người ta thu được 8,40 lít khí CO2 (đktc) và 4,5 g H2O. Xác định phần trăm khối lượng của từng nguyên tố trong hợp chất hữu cơ đó.
Bài 8. Để đốt cháy hoàn toàn 2,50 g chất A phải dùng vừa hết 3,36 lít O2 (đktc). Sản phẩm cháy chỉ có CO2 và H2O, trong đó khối lượng CO2 hơn khối lượng H2O là 3,70 g. Tính phần trăm khối lượng của từng nguyên tố trong A.
Bài 9. Oxi hoá hoàn toàn 6,15 g chất hữu cơ X, người ta thu được 2,25 g H2O; 6,72 lít CO2 và 0,56 lít N2 (các thể tích đo ở đktc).
Dạng 2: Lập CTPT hợp chất hữu cơ
Phần bài tập hướng dẫn giải
Bài 1. Nilon – 6, loại tơ nilon phổ biến nhất có 63,68% C; 9,08 % H; 14,14% O; và 12,38% N. Xác định công thức đơn giản nhất của nilon – 6.
Hướng dẫn giải bài tập
Ta có nC:nH:nN = ![]()
Công thức thực nghiệm của nilon là C6H11ON
Bài 2. Kết quả phân tích các nguyên tố trong nicotin như sau: 74% C; 8,65% H; 17,35% N. Xác định công thức đơn giản nhất của nicotin, biết nicotin có khối lượng mol phân tử là 162.
Đáp án hướng dẫn giải
Gọi CT nicotin là CxHyNz
x : y : z = %C/12: %H/1: %N/14 = 74/12 : 8,65/1 : 17,35/14= 5: 7 :1
=> CT (C5H7N)n . Mà M = (12.5 + 7 + 14)n = 162 => n = 2 => CT: C10H14N2
Bài 3. Đốt cháy hoàn toàn 5,6 g hợp chất hữu cơ A thu được 13,2 g CO2 và 3,6 g H2O. Tỉ khối của A so với H2 là 28. Xác định CTPT của A.
Đáp án hướng dẫn giải
Ta có nCO2 = nC = 0,3
nH = 2nH2O = 0,4
mO trong A = 5,6 - 0,3.12 - 0,4= 1,6 => nO = 0,1mol
=> CT (C3H4O)n . M = ( 12.3 + 4 + 16)n = 28.2=> n = 1 => CT A: C3H4O
Bài 4. Đốt cháy hoàn toàn 0,30 g chất A (chứa C, H, O) thu được 0,44 g CO2 và 0,18 g H2O. Thể tích hơi của của 0,30 g chất A bằng thể tích của 0,16g khí oxi (ở cùng đk về nhiệt độ và áp suất). Xác định CTPT của chất A.
Đáp án hướng dẫn giải
Gọi công thức hợp chất hữu cơ là CxHyOz (x,y,z nguyên dương)
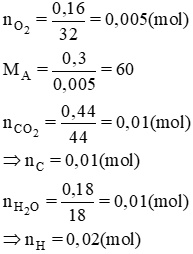
mO = mA – (mC + mH) = 0,3 - (0,01.12 + 0,02.1) = 0,16(g)
⇒ nO = = 0,01(mol)
nC : nH : nO = 0,01 : 0,02 : 0,01 = 1 : 2 : 1
⇒ công thức phân tử (CH2O)n
Ta có: mA = 30n = 60 ⇒ n = 2
⇒ Công thức phân tử của A là C2H4O2
Bài 5. Từ tinh dầu hồi, người ta tách được anetol – một chất thơm được dùng sản xuất kẹo cao su. Anetol có khối lượng mol phân tử bằng 148 g/mol. Phân tích nguyên tố cho thấy, anetol có %C = 81,08%; %H = 8,10% còn lại là oxi. Lập công thức đơn giản nhất và CTPT của anetol.
Đáp án hướng dẫn giải
%O = 100% - 81,08% - 8,1% = 10, 82%
x : y : z = ![]()
= 10: 12: 1
=> Công thức đơn giản nhất = C10H12O
=> (C10H12O)n = 148 => n = 1 => CTPT : C10H12O
Bài 6. Hợp chất X có phần trăm khối lượng C, H, O lần lượt bằng 54,54%; 9,10% và 36,36%. Khối lượng mol phân tử của X bằng 88. Xác định CTPT của X.
Đáp án hướng dẫn giải
Gọi công thức tổng quát của X là CxHyOz (x,y,z € N*)
![]()
=> Công thức đơn giản nhất của X là C2H4O
=> Công thức tổng quát là (C2H4O)n
Ta có: MX = 88 (g/mol)
(12.2 + 4+ 16)n = 88
=> n = 2
Vậy công thức phân tử là C4H8O2
Bài 7. Từ tinh dầu chanh người ta tách được chất limonen thuộc loại hydrocarbon có hàm lượng nguyên tố H là 11,765%. Hãy tìm CTPT của limonen, biết tỉ khối hơi của limonen so với heli bằng 34.
Đáp án hướng dẫn giải
Gọi công thức của limonen là CxHy
Ta có:
%H = 100% - %H = 100% -11,765% = 88,235%
Dlimonen/kk = 4,69 →Mlimonen = 4,69.29 = 136
Ta có:
![]()
→ x : y = 5: 8
Vậy công thức đơn giản nhất của limonen là (C5H8)n
Vì Mlimonen = 136 →→ n(12.5 + 8.1) = 136 →→ n = 2
Vậy công thức phân tử của limonen là C10H16
Bài 8. Đốt cháy hoàn toàn hợp chất hữu cơ A cần vừa đủ 7,437 lít O2 (ở đkc) thu được 13,2 g CO2 và 5,4 g H2O. Biết tỉ khối hơi của A so với không khí gần bằng 1,0345. Xác định CTPT của A.
Đáp án hướng dẫn giải
nO2 = 7,437 : 24,79 = 0,3 mol
Bảo toàn khối lượng: mA + mO2 = mH2O + mCO2
→ mA = 13,2 + 5,4 - 0,3 . 32 = 9 (g)
nCO2 = 13,2 : 44 = 0,3 mol
nH2O = 5,4 : 18 = 0,3 mol
Gọi CTPT của A là CxHyOz
Trong A có:
nC = nCO2 = 0,3 mol
nH = 2nH2O = 0,6 mol
Bảo toàn nguyên tố O: nO = 2.nCO2 + nH2O - 2.nO2 = 0,3 mol
x:y:z = nC : nH : nO = 0,3 : 0,6 : 0,3 = 1:2:1
→ CTĐGN của A: CH2O
→ A có dạng (CH2O)n
MA = 29 . 1,0345 = 30
30n = 30 → n = 1
Phần bài tập tự luyện
Bài 9. Đốt cháy hoàn toàn 2,20 g chất hữu cơ X người ta thu được 4,40 g CO2 và 1,80 g H2O.
- Xác định công thức đơn giản nhất của chất X.
- Xác định CTPT chất X biết rằng nếu làm bay hơi 1,10 g chất X thì thể tích hơi thu được đúng bằng thể tích của 0,40 g khí oxygen ở cùng đk nhiệt độ và áp suất.
Đáp án hướng dẫn giải
a/ Ta có: nCO2 = 0,1 mol ⇒ mC =1,2 (g)
nH2O = 0,1 mol ⇒ mH = 0,2 (g)
Ta có: mA > mC + mH
Vậy trong A có O ⇒mO = mA −(mC + mH) = 0,8 (g) →nO = 0,05 (mol)
Gọi công thức của chất hữu cơ A: CxHyOz
Khi đó: x : y : z = nC:nH:nO = 0,1 : 0,2 : 0,05 = 2 : 4 : 1
⇒ công thức đơn giản nhất của A: C2H4O
b/ Ta có: nA = nO2 = 0,4/32 = 0,0125 mol
⇒ MA = 1,1/0,0125 = 88
⇒(12 + 4 + 32).n = 88 → n = 2
Vậy A là: C4H8O2
Bài 10. Để đốt cháy hoàn toàn 2,85 g chất hữu cơ X phải dùng hết 4,648125 lít khí oygen (đkc). Sản phẩm cháy chỉ có CO2 và H2O theo tỉ lệ khối lượng 44 : 15.
- Xác định công thức đơn giản nhất của X.
- Xác định CTPT của X biết rằng thỉ khối hơi của X đối với C2H6 là 3,80.
Đáp án hướng dẫn giải
Sơ đồ phản ứng: X + O2 → CO2 + H2O
nO2 = 0,1875 mol
Gọi khối lượng của CO2 và H2O tương ứng là 44a và 15a.
Bảo toàn khối lượng:
mX + mO2 = mCO2 + mH2O
![]()
Bảo toàn nguyên tố C, H:
nC(X) = nCO2 = 0,15mol; nH(X) = 2nH2O = 0,25mol
Ta có
mX = mC + mH + mO
→ mO = 2,85−0,15.12−0,25.1 = 0,8 gam
→ nO = 0,05 mol
Xét tỉ lệ: nC : nH : nO = 0,15:0,25:0,05 = 3:5:1
→ Công thức đơn giản nhất của chất X là: C3H5O
b. Công thức phân tử của X có dạng: (C3H5O)n
Ta có:
dX/C2H6 = 3,8→MX = 3,8.30 = 114 →(12.3+5+16).n = 114 → n = 2
Công thức phân tử của chất X: C6H10O2
*Bài 11. Để đốt cháy hoàn toàn 4,45 g chất hữu cơ X phải dùng hết 4,648125 lít khí oxygen (đktc). Sản phẩm cháy gồm có 3,15 g H2O và 3,92 lít hỗn hợp khí gồm CO2 và N2 (đktc). Xác định CTĐGN của X.
nO2 = 0,1875 mol ; nH2O = 0,175 mol
Đặt nCO2 = x; nN2 = y
+ Bảo toàn khối lượng : 44x + 28y = mA + mO2 – mH2O = 7,3g (1)
+ n(CO2 + N2) = 0,175 => x + y = 0,175 (2)
=> x = 0,15 ; y = 0,025 mol
Bảo toàn O : nO(A) = 2nCO2 + nH2O – 2nO2 = 0,1 mol
=> nC : nH : nO : nN = 0,15 : 0,35 : 0,1 : 0,05 = 3 : 7 : 2 : 1
Công thức phân tử của A chỉ có 1 nguyên tử N => A là C3H7O2N
-----------------------------------------------
Chi tiết nội dung câu hỏi ở FILE TẢI VỀ mời các bạn tham khảo.









