Giải bài tập Hóa 11 bài 27: Luyện tập Ankan và xicloankan
Mời thầy cô cùng các bạn học sinh 11 tham khảo tài liệu Giải bài tập trang 123 SGK Hóa học lớp 11: Luyện tập Ankan và xicloankan, hy vọng qua bộ tài liệu các bạn học sinh sẽ rèn luyện cách giải bài tập Hóa học một cách đơn giản hơn.
Giải bài tập Hóa 11: Luyện tập Ankan và xicloankan
A. Tóm tắt lý thuyết Hóa 11 bài 25
I. Ankan
1. Phản ứng thế nguyên tử hidro bằng nguyên tử halogen
CnH2n+2 + X2 ![]() \(\overset{as. t^{o} }{\rightarrow}\) CnH2n+1X + HX
\(\overset{as. t^{o} }{\rightarrow}\) CnH2n+1X + HX
2. Phản ứng tách
CH3CH2CH3 ![]() \(\overset{xt, as}{\rightarrow}\) CH2=CHCH3 + CH2=CH2 + CH4 + H2
\(\overset{xt, as}{\rightarrow}\) CH2=CHCH3 + CH2=CH2 + CH4 + H2
3. Phản ứng cháy
2CnH2n+2 + (3x + 1)O2 → 2nCO2 + 2(n + 1) H2O
4. Điều chế
Trong phòng thí nghiệm:
CnH2n+1COONa + NaOH ![]() \(\overset{CaO, t^{o} }{\rightarrow}\) CnH2n+2 + Na2CO3 (với 1 ≤ x ≤ 4)
\(\overset{CaO, t^{o} }{\rightarrow}\) CnH2n+2 + Na2CO3 (với 1 ≤ x ≤ 4)
Từ cacbua kim loại để điều chế metan:
Al4C3 + 12H2O → 3CH4 + 4 Al(OH)3
II. Xicloankan
Các xicloankan có tính chất tương tự ankan: thế nguyên tử H.
Các xicloankan vòng 3 hoặc 4 cạnh có phản ứng cộng mở vòng
Các xicloankan vòng 4 cạnh trở lên không làm mất màu dung dịch thuốc tím ở điều kiện thường.
B. Giải Hóa 11 bài 27: Luyện tập Ankan và xicloankan
Bài 1 trang 123 SGK Hóa 11
Viết các công thức cấu tạo của các ankan sau: pentan, 2-metylbutan, isobutan. Các chất trên còn có tên gọi nào khác không?
Đáp án hướng dẫn giải chi tiết
CH3-CH2-CH2-CH2-CH3 có tên khác là: n-pentan
CH3- CH(CH)3-CH2−CH3 có tên khác là: isopentan
CH3- CH(CH3)-CH3 có tên gọi khác là: 2-metylbutan
Bài 2 trang 123 SGK Hóa 11
Ankan Y mạch không nhánh có công thức đơn giản nhất là C2H5
a. Tìm công thức phân tử, viết công thức cấu tạo và gọi tên chất Y.
b. Viết phương trình hóa học phản ứng của Y với clo khi chiếu sáng, chỉ rõ sản phẩm chính của phản ứng.
Đáp án hướng dẫn giải chi tiết
a. Vì ankan Y có công thức đơn giản nhất là C2H5 nên gọi CTPT của Y là (C2H5)x hay C2xH5x (x ≥ 1)
Vì Y là ankan nên ta có: 5x = 2.2x + 2 (số phân tử H = 2 (số phân tử C) + 2)
=> x = 2
Vậy CTCT của Y là: CH3-CH2-CH2-CH3: butan
b. Phương trình phản ứng:
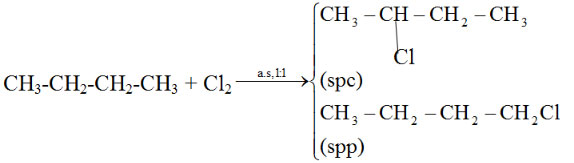
Bài 3 trang 123 SGK Hóa 11
Đốt cháy hoàn toàn 3,36,lít hỗ hợp khí A gồm metan và etan thu được 4,48 lít khí cacbonic. Các thể khí được đo ở điều kiện tiêu chuẩn. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A.
Đáp án hướng dẫn giải chi tiết
![]() \(n_{A} = \frac{3,36}{22,4} = 0,15mol\)
\(n_{A} = \frac{3,36}{22,4} = 0,15mol\)
![]() \(n_{CO2} = \frac{4,48}{22,4} = 0,2mol\)
\(n_{CO2} = \frac{4,48}{22,4} = 0,2mol\)
Gọi số mol của metan và etan lần lượt là x và y (mol)
Phương trình phản ứng:
CH4 + 2O2 → CO2 + 2H2O
x x (mol)
C2H6 + 72O2 → 2CO2 + 3H2O
y 2y (mol)
Ta có hệ phương trình
 \(\left\{ \begin{array}{l}
x + y = 0,15\\
x + 2y = 0,2
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,1(mol)\\
y = 0,05(mol)
\end{array} \right.\)
\(\left\{ \begin{array}{l}
x + y = 0,15\\
x + 2y = 0,2
\end{array} \right. = > \left\{ \begin{array}{l}
x = 0,1(mol)\\
y = 0,05(mol)
\end{array} \right.\)
Vậy thành phần phần trăm về thể tích các khí trong hỗn hợp A là:
%VCH4 = %nCH4 = 0,1/0,15.100% = 66,7%
%VC2H6 = 100% - 66,67% = 33,33%
Bài 4 trang 123 SGK Hóa 11
Khi 1,00 g metan cháy tỏa ra 55,6 kJ. Cần đốt bao nhêu lít khí metan (đktc) để lượng nhiệt sinh ra đủ đun 1,00 lít nước (D = 1,00 g/cm3) từ 25,0oC lên 100,0oC. Biết rằng muốn nâng 1,00g nước lên 1,0oC cần tiêu tốn 4,18J và giả sử nhiệt sinh ra chỉ dùng để làm tăng nhiệt độ của nước.
Đáp án hướng dẫn giải chi tiết
Khối lượng của 1,00 lit nước là:
m = D.V = 1,00.1000 = 1000g
Nhiệt lượng mà 1000 gam nước thu vào để tăng nhiệt độ từ 25oC đến 100oC là:
Q = 1000.4,18 100 - 25) = 313.500 (J)
Đó là nhiệt lượng mà khí metan khi đốt cháy cầ phải toả ra.
Khối lượng metan cần phải đốt cháy là:
![]() \(m = \frac{313500}{55,6.1000} = \frac{3135}{556}\left(gam\right)\)
\(m = \frac{313500}{55,6.1000} = \frac{3135}{556}\left(gam\right)\)
Số mol metan cần phải đốt cháy là:
![]() \(n = \frac{m}{M} = \frac{{3135}}{{556.16}} = \frac{{3135}}{{8896}}(gam)\)
\(n = \frac{m}{M} = \frac{{3135}}{{556.16}} = \frac{{3135}}{{8896}}(gam)\)
Vậy thể tích khí metan (đktc) cần phải đốt cháy là:
![]() \(V = n.22,4 = \frac{{3135}}{{8896}}.22,4 = 7,89l\)
\(V = n.22,4 = \frac{{3135}}{{8896}}.22,4 = 7,89l\)
Bài 5 trang 123 SGK Hóa 11
Khi cho pentan tác dụng với brom theo tỉ lệ 1:1, sản phẩm chính thu được là:
A. 2- brompentan
B. 1-brompentan
C. 1,3 – đibrompentan
D. 2,3 – đibrompentan
Hãy chọn đáp án đúng
Đáp án hướng dẫn giải chi tiết
Đáp án A 2- brompentan
Bài 6 trang 123 SGK Hóa 11
Đánh dấu Đ (đúng) hoặc S (sai) vào các ô trống cạnh các câu sau đây:
a. Ankan là hidrocacbon no, mạch hở.
b. Ankan có thể bị tách hidro thành anken.
c. Crăckinh ankan thu được hỗn hợp các ankan.
d. Phản ứng của clo với ankan tạo thành ankyl clorua thuộc loại phản ứng thế.
e. Ankan có nhiều trong dầu mỏ.
Đáp án hướng dẫn giải chi tiết
Đúng: a. Ankan là hidrocacbon no, mạch hở.
Đúng b. Ankan có thể bị tách hidro thành anken.
Sai: c. Crăckinh ankan thu được hỗn hợp các ankan.
Đúng: d. Phản ứng của clo với ankan tạo thành ankyl clorua thuộc loại phản ứng thế.
Đúng: e. Ankan có nhiều trong dầu mỏ.
--------------------------------------
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Giải bài tập Hóa 11 Bài 27: Luyện tập Ankan và xicloankan. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Hóa học lớp 10, Giải bài tập Hóa học lớp 11, Thi thpt Quốc gia môn Văn, Thi thpt Quốc gia môn Lịch sử, Thi thpt Quốc gia môn Địa lý, Thi thpt Quốc gia môn Toán, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11 mà VnDoc tổng hợp và đăng tải.
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, VnDoc mời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.









