Giải bài tập Hóa 11 Bài 45: Axit cacboxylic
Giải bài tập Hóa 11 trang 210 Axit cacboxylic
Giải bài tập Hóa 11 Bài 45: Axit cacboxylic được VnDoc giới thiệu mời thầy cô cùng các bạn học sinh tham khảo, chắc chắn bộ tài liệu sẽ là nguồn thông tin hữu ích để giúp các bạn học sinh rèn luyện các phương pháp giải bài tập cũng như biết cách vận dụng giải bài tập tương tự Hóa học 11 một cách nhanh và chính xác nhất.
Bài 1 trang 210 SGK Hóa 11
Thế nào là axit cacbonxylic? Viết công thức cấu tạo, gọi tên các axit có công thức phân tử C4H2O2.
Đáp án hướng dẫn giải
Định nghĩa axit cacboxylic: là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon(1) hoặc nguyên tử hiđro.
((1): Nguyên tử cacbon này có thẻ của gốc hiđrocacbon hoặc của nhóm -COOH khác.)
CH3-CH2-CH2-COOH: axit butanoic
CH3-CH(CH3)-COOH: axit - 2-metylpropanoic
Bài 2 trang 210 SGK Hóa 11
Từ công thức cấu tạo, hãy giải thích tại sao axit fomic có tính chất của một anđehit.
Đáp án hướng dẫn giải
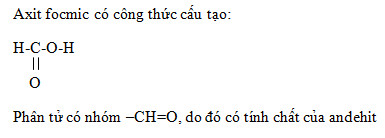
Bài 3 trang 210 SGK Hóa 11
Từ metan và các chất vô cơ cần thiết khác có thể điều chế được axit fomic, axit axetic. Viết phương trình hóa học của các phản ứng xảy ra.
Đáp án hướng dẫn giải
CH4 + Cl2 ![]() \(\overset{as,1:1}{\rightarrow}\) CH3Cl + HCl
\(\overset{as,1:1}{\rightarrow}\) CH3Cl + HCl
CH3Cl + NaOH ![]() \(\overset{t^{\circ } }{\rightarrow}\) CH3OH + NaCl
\(\overset{t^{\circ } }{\rightarrow}\) CH3OH + NaCl
CH3OH + CuO ![]() \(\overset{t^{\circ } }{\rightarrow}\) HCHO + Cu + H2O
\(\overset{t^{\circ } }{\rightarrow}\) HCHO + Cu + H2O
2HCHO + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2HCOOH
\(\overset{t^{\circ } }{\rightarrow}\) 2HCOOH
2CH4 ![]() \(\overset{1500^{\circ }C, lln }{\rightarrow}\) C2H2 + 3H2
\(\overset{1500^{\circ }C, lln }{\rightarrow}\) C2H2 + 3H2
CH≡CH + H2 ![]() \(\overset{Pd, PbCO_{3} ,t^{\circ } }{\rightarrow}\) CH2=CH2
\(\overset{Pd, PbCO_{3} ,t^{\circ } }{\rightarrow}\) CH2=CH2
CH2=CH2 + HOH ![]() \(\overset{t^{\circ },xt }{\rightarrow}\) CH3-CH2OH
\(\overset{t^{\circ },xt }{\rightarrow}\) CH3-CH2OH
CH3-CH2OH + O2 ![]() \(\overset{enzim
}{\rightarrow}\) CH3COOH + H2O
\(\overset{enzim
}{\rightarrow}\) CH3COOH + H2O
Bài 4 trang 210 SGK Hóa 11
Chất Y có công thức phân tử C4H8O2 tác dụng với NaOH tạo thành chất Z (C4H7O2Na). Vậy Y thuộc loại hợp chất nào sau đây?
A. Anđehit
B. Axit.
C. Ancol
D. Xeton.
Đáp án hướng dẫn giải
Đáp án B.
Phương trình minh họa:
CH3CH2CH2COOH + NaOH → CH3CH2CH2COONa + H2O
Bài 5 trang 210 SGK Hóa 11
Để trung hòa 150,0 gam dung dịch 7,40% của axit no, mạch hở, đơn chức X cần dùng 100,0 ml dung dịch NaOH 1,50M. Viết công thức cấu tạo và gọi tên của chất X.
Đáp án hướng dẫn giải
Gọi công thức phân tử của X là CnH2n+1COOH (n ≥ 1)
Ta có:
![]() \(m_X=\frac{C\%m_{dd}}{100\%}=\frac{7,4.150}{100}=11,1\;gam\)
\(m_X=\frac{C\%m_{dd}}{100\%}=\frac{7,4.150}{100}=11,1\;gam\)
mNaOH = 0,1.1,5 = 0,15(mol)
Phương trình phản ứng:
CnH2n+1COOH + NaOH → CnH2n+1COONa + H2O
Theo phương trình: nCnH2n+1COOH = nNaOH = 0,15 (mol)
=> MCnH2n+1COOH = maxit : nCnH2n+1COOH = 11,1:0,15 = 74 (g/mol)
=> 14n + 46 = 74
=> n =2
Vậy công thức cấu tạo của axit là C2H5COOH: axit propionic
Bài 6 trang 210 SGK Hóa 11
Trung hòa 16,60gam hỗn hợp gồm axit axetic và axit fomic bằng dung dịch natri hiđroxit thu được 23,20 gam hỗn hợp hai muối.
a. Viết phương trình hóa học của các phản ứng ở dạng phân tử và ion rút gọn.
b. Xác định thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp trước và sau phản ứng.
Đáp án hướng dẫn giải
a) Gọi số mol của axit axetic và axit fomic lần lượt là x và y (mol)
Phương trình hoá học ở dạng phân tử:
CH3COOH + NaOH → CH3COONa + H2O
x x (mol)
HCOOH + NaOH → HCOONa + H2O
y y (mol)
Phương trình hoá học ở dạng ion:
CH3COOH + OH- → CH3COO- + H2O
HCOOH + OH- → HCOO- + H2O
b) Theo đề bài ta có hệ phương trình:
![]() \(\left\{\begin{array}{l}60x+46y=16,60\\82x+68y=23,20\end{array}\right.\Leftrightarrow\left\{\begin{array}{l}x=0,2\;mol\\y=0,1\;mol\end{array}\right.\)
\(\left\{\begin{array}{l}60x+46y=16,60\\82x+68y=23,20\end{array}\right.\Leftrightarrow\left\{\begin{array}{l}x=0,2\;mol\\y=0,1\;mol\end{array}\right.\)
=> mCH3COOH = 0,2.60 = 12 gam
![]() \(\%m_{CH_3COOH}\;=\frac{12}{16,60}.100\%=72,3\%\)
\(\%m_{CH_3COOH}\;=\frac{12}{16,60}.100\%=72,3\%\)
=> %mHCOOH = 100% - 72,3% = 27,7%
mCH3COONa = 0,2.82 = 16,4 gam
=> ![]() \(\%m_{CH_3COONa}=\frac{16,4}{23,20}.100\%\;=70,7\%\)
\(\%m_{CH_3COONa}=\frac{16,4}{23,20}.100\%\;=70,7\%\)
=>%mHCOONa = 100% - 70,7% = 29,3%
Bài 7 trang 210 SGK Hóa 11
Đun 12,0 gam axit axetic với một lượng dư ancol etylic ( có axit H2SO4 đặc làm xúc tác). Đến khi dừng thí nghiệm thu được 12,3 gam este.
a. Viết phương trình hóa học của phản ứng.
b. Tính phần trăm khối lượng của axit đã tham gia phản ứng este hóa.
Đáp án hướng dẫn giải
a) Phương trình hóa học:
CH3COOH + C2H5OH ![]() \(\overset{H_{2} SO_{4} ,t^{\circ } }{\rightleftharpoons}\) CH3COOC2H5 + H2O
\(\overset{H_{2} SO_{4} ,t^{\circ } }{\rightleftharpoons}\) CH3COOC2H5 + H2O
b)
nCH3COOH = 12/60 = 0,2 mol
nCH3COOC2H5 = 12,3/88 = 0,14 mol
Ta thấy 0,2 > 0,14 mà theo phương trình ta có:
nCH3COOH = nCH3COOC2H5 từ đó suy ra CH3COOH dư
=> nCH3COOH tham gia phản ứng = nCH3COOC2H5 = 0,14 mol
=> Phần trăm axit bị este hóa là: (0,14/0,2).100% = 70%
-------------------------------------
Để làm được các dạng bài tập sách giáo khoa hóa 11 trang 210 các bạn học sinh phải nắm chắc được nội dung kiến thức lý thuyết hóa 11 bài 45. Từ đó vận dụng giải bài tập.
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Giải bài tập Hóa 11 Bài 45: Axit cacboxylic. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Hóa học lớp 10, Giải bài tập Hóa học lớp 11, Thi thpt Quốc gia môn Văn, Thi thpt Quốc gia môn Lịch sử, Thi thpt Quốc gia môn Địa lý, Thi thpt Quốc gia môn Toán, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11 mà VnDoc tổng hợp và đăng tải.
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, VnDoc mời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.








