Hóa 11 bài 22: Cấu trúc phân tử hợp chất hữu cơ
Cấu trúc phân tử hợp chất hữu cơ
Hóa 11 bài 22: Cấu trúc phân tử hợp chất hữu cơ được VnDoc biên sọa, tổng hợp nội dung kiến thức Bài 22 hóa 11. Cũng như đưa ra các nội dung câu hỏi, bài tập liên quan. Giúp củng cố, nâng cao kĩ năng, kiến thức cho bài học. Mời các bạn tham khảo.
A. Tóm tắt lý thuyết Hóa 11 bài 22
I. Công thức cấu tạo
1. Khái niệm
Công thức cấu tạo biểu diễn thứ tự và cách thức liên kết (liên kết đơn, liên kết bội) của các nguyên tử trong phân tử.
2. Các loại công thức cấu tạo
a. Công thức cấu tạo khai triển
Biểu diễn trên mặt phẳng giấy tất cả các liên kết.
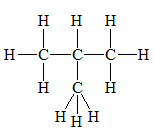
b. Công thức cấu tạo thu gọn
Các nguyên tử, nhóm nguyên tử cùng liên kết với một nguyên tử cacbon được viết thành một nhóm.
Thí dụ
CH3-CH2-CH3
CH3-CH2-COOH
CH2=CH2
Chỉ biểu diễn liên kết giữa các nguyên tử cacbon và với nhóm chức. Mỗi đầu một đoạn thẳng hoăc điểm gấp khúc ứng với một nguyên tử cacbon; không biểu thị số nguyên tử hiđro liên kết với mỗi nguyên tử cacbon.
II. Thuyết cấu tạo hóa học
1. Nội dung
a) Trong phân tử hợp chất hữu cơ, các nguyên tử liên kết với nhau theo đúng hóa trị và theo một thứ tự nhất định. Thứ tự liên kết đó gọi là cấu tạo hóa học. Sự thay đổi thứ tự liên kết đó, tức là thay đổi cấu tạo hóa học, sẽ tạo ra hợp chất khác.
Thí dụ:
Ancol etylic và đimetyl ete đều có công thức phân tử C2H6O, nhưng chúng có cấu tạo hóa học khác nhau.
|
Ancol etylic CH3-CH2-OH ts = 78,3oC Tan vô hạn trong nước, tác dụng với natri sinh khí hidro |
Đimetyl ete CH3-O-CH3 ts = -23oC Tan ít trong nước, không tác dụng với natri |
b) Trong phân tử hợp chất hữu cơ, cacbon có hóa trị bốn. Nguyên tử cacbon không những có thể liên kết với nguyên tử của các nguyên tố khác mà còn liên kết với nhau tạo thành mạch cacbon (mạch vòng, mạch không vòng, mạch nhánh, mạch không
c) Tính chất của các chất phụ thuộc vào thành phần phân tử (bản chất, số lượng các nguyên tử) và cấu tạo hóa học (thứ tự liên kết các nguyên tử).
2. Ý nghĩa
Thuyết cấu tạo hóa học giúp giải thích được hiện tượng đồng đẳng, hiện tượng đồng phân.
III. Đồng đẳng, đồng phân
1. Đồng đẳng
Những hợp chất có thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 nhưng có tính chất hoá học tương tự nhau là những chất đồng đẳng, chúng hợp thành dãy đồng đẳng.
Thí dụ: Xét các hidrocabon
C2H4 (CH2=CH2)
C3H6 (CH2=CH-CH3)
C4H8 (CH2=CH-CH2-CH3; CH3-CH=CH-CH3; .....)
Các chất trong cùng dãy đồng đẳng có cấu tạo hóa học tương tự nhau nên có tính chất hóa học tương tự nhau.
2. Đồng phân
Khái niệm: Những hợp chất khác nhau nhưng có cùng công thức phân tử được gọi là các chất đồng phân của nhau.
Thí dụ: CH3-CH2-OH và CH3-O-CH3 đều có cùng công thức phân tử là C2H6O
Có nhiều loại đồng phân:
Đồng phân cấu tạo (gồm đồng phân mạch cacbon,
Đồng phân loại nhóm chức,
Đồng phân vị trí liên kết bội hoặc nhóm chức,...)
Đồng phân lập thể (đồng phân khác nhau về vị trí không gian của các nhóm nguyên tử).
IV. Liên kết hóa học và cấu trúc phân tử hợp chất hữu cơ
Liên kết hóa học thường gặp nhất trong phân tử các hợp chất hữu cơ là liên kết cộng hóa trị. Liên kết cộng hóa trị được chia thành hai loại: liên kết xich ma (σ) và liên kết pi (π).
Sự tổ hợp liên kết σ với liên kết π tạo thành liên kết đôi hoặc liên kết ba.
1. Liên kết đơn
Liên kết đơn (hay liên kết σ) do một cặp electron chung tạo nên và được biểu diễn bằng một gạch nối giữa hai nguyên tử. Liên kết σ là liên kết bền.
Thí dụ: CH4
2. Liên kết đôi
Liên kết đôi do 2 cặp electron chung giữa 2 nguyên tử tạo nên. Liên kết đôi gồm một liên kết σ và một liên kết π. Liên kết n kém bền hơn liên kết σ nên dễ bị đứt ra trong các phản ứng hóa học. Liên kết đôi được biểu diễn bằng hai gạch nối song song giữa hai nguyên tử.
Thí dụ: C2H4
CTCT thu gọn: CH2=CH2
Mỗi nguyên tử cacbon của liên kết đôi còn tạo được hai liên kết đơn với hai nguyên tử khác. Bốn nguyên tử liên kết trực tiếp với hai nguyên tử cacbon của liên kết đôi nằm trong cùng mặt phẳng với hai nguyên tử cacbon đó.
3. Liên kết ba
Liên kết ba do 3 cặp electron chung giữa 2 nguyên tử tạo nên. Liên kết ba gồm một liên kết σ và hai liên kết n. Liên kết ba được biểu diễn bằng ba gạch nối song song giữa hai nguyên tử.
Thí dụ: C2H2
CTCT thu gọn HC ≡ CH
Mỗi nguyên tử C của liên kết ba còn tạo được một liên kết đơn với một nguyên tử khác. Hai nguyên tử liên kết với hai nguyên tử cacbon của liên kết ba nằm trên đường thẳng nối hai nguyên tử cacbon.
B. Giải Hóa 11 Bài 22 Cấu trúc phân tử hợp chất hữu cơ
Để giúp bạn đọc học tập tốt hơn, cũng như hoàn thành tốt các dạng câu hỏi bài tập sách giáo khoa. VnDoc biên soạn hướng dẫn bạn đọc trả lời tại: Giải bài tập Hóa 11 Bài 22: Cấu trúc phân tử hợp chất hữu cơ
.......................................
Trên đây VnDoc đã giới thiệu tới các bạn Hóa 11 bài 22: Cấu trúc phân tử hợp chất hữu cơ. Để có thể nâng cao kết quả trong học tập mời các bạn tham khảo một số tài liệu: Giải bài tập Hóa học lớp 11, Thi thpt Quốc gia môn Địa lý, Thi thpt Quốc gia môn Toán, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11 mà VnDoc tổng hợp và đăng tải.
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, VnDoc mời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.










