Bài tập chương Cacbon - Silic
Bài tập chương Cacbon - Silic
Bài tập Cacbon - Silic là tài liệu tổng hợp các bài tập Hóa học 11 chương 3: Cacbon - Silic, là tài liệu bao gồm bài tập trắc nghiệm và bài tập tự luận giúp các bạn ôn tập kiến thức hóa học lớp 11 được chắc chắn và toàn diện nhất trong chương 3: Cacbon - Silic. Mời các bạn tham khảo.
Chương 3: CACBON VÀ HỢP CHẤT CỦA CACBON
1. VIẾT PHƯƠNG TRÌNH PHẢN ỨNG & PHÂN BIỆT CÁC CHẤT
Câu 1. Ở nhiệt độ cao cacbon có thể phản ứng với nhiều đơn chất và hợp chất. Lập các phương trình hóa học sau và nêu vai trò của cacbon trong từng phản ứng
a. C + S → ? b. C + Al → ? c. C + Ca → ? d. C + H2O → ? e. C + CuO →?
f. C + HNO3(đặc) → ? g. C + H2SO4 (đặc) → ? h. C + KClO3 → ?
Câu 2. Hoàn thành các phương trình hóa học sau:
a. CO + O2 (toC)→ ? b. CO + Cl2 (có toC, xt)→ ? c. CO + CuO (toC) → ?
d. CO + Fe3O4 (toC) → ? f. CO + I2O5 (toC) → ?
Câu 3. Hoàn thành các phương trình hóa học sau:
a. CO2 + Mg (đk toC) → ? b. CO2 + CaO → ? c. CO2 (dư) + Ba(OH)2 →?
d. CO2 + H2O → ? e. CO2 + CaCO3 + H2O → ? f. CO2 + H2O (đk:ánh sáng, diệp lục) → C6H12O6 + ?
Câu 4. Làm thế nào để loại hơi nước và khí CO2 có lẫn trong khí CO? Viết phương trình phản ứng.
Câu 5. Viết các phương trình của các phản ứng chuyển hóa các chất trong sơ đồ sau
CO2 → C → CO → CO2 → CaCO3 → Ca(HCO3)2 → CO2
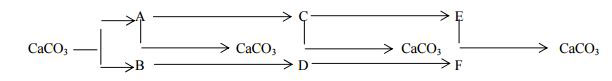
Câu 6. Hoàn thành sơ đồ sau (mỗi chữ cái là một chất riêng biệt)
Câu 7. Viết phương trình phản ứng của Ba(HCO3)2 với các dung dịch HNO3, Ca(OH)2, Na2SO4, NaHSO4.
Câu 8.Viết phương trình hoá học (nếu có) dạng phân tử và ion rút gọn khi cho Na2CO3 lần lượt tác dụng với; dd BaCl2, dd FeCl3, dd AlCl3, dd HNO3.
Câu 9.
a. Tại sao người ta không dùng bình cứu hỏa CO2 để chữa các đám cháy có mặt của kim loại như Mg, Al? Giải thích, viết phương trình phản ứng.
b. Nước đá khô có cấu tạo mạng tinh thể gì? Và nước đá khô là chất nào?
Câu 10.
a. Khí CO2 không phải là khí độc nhưng ảnh hưởng gì đến môi trường sống của trái đất
b. Tại sao hàm lượng CO2 trong khí quyển của hành tinh của chúng ta được giữ gần như không đổi.
Câu 11. Viết phương trình phản ứng dạng phân tử và ion thu gọn của dung dịch NaHCO3 với từng dung dịch H2SO4 loãng, KOH, Ba(OH)2 dư.
Câu 12: Viết các phản ứng hóa học có thể xảy ra khi cho CO2 đi qua dung dịch NaOH.
Câu 12a. Trình bày hiện tượng xảy ra khi sục khí CO2 qua ndung dịch Ca(OH)2. Giải thích.
Câu 13. Trình bày phương pháp hóa học phân biệt các chất rắn chứa trong các lọ riêng biệt: NaHCO3, NaNO3, Na2SiO3, Na3PO4, NaCl
Câu 14. Cho 3 bình dung dịch mất nhãn là: A gồm KHCO3 và K2CO3, B gồm KHCO3 và K2SO4, D gồm K2CO3 và K2SO4. Chỉ dùng dung dịch BaCl2 và dung dịch HCl, nêu cách nhận biết mỗi bình dung dịch mất nhãn trên, viết các phương trình phản ứng
Câu 15. Có 4 muối riêng biệt đựng trong 4 ống nghiệm mất nhãn: NaCl, Na2SO4, CaCO3, BaCO3. Dùng khí CO2 và H2O để nhận biết các muối trên
Câu 16. Có 5 lọ mất nhãn, mỗi lọ đựng một trong các dd sau: NaHSO4, KHCO3, Mg(HCO3)2, Na2SO3, Ba(HCO3)2. Trình bày cách nhận biết từng dung dịch. Chỉ được dùng thêm cách đun nóng.
Câu 17. Bằng phưong pháp hóa học hãy phân biệt:
a. Các khí SO2, CO2, NH3 và N2 b. Các khí CO2, SO2, N2, O2 và H2
c. Các khí CO, CO2, SO2 và SO3 (khí) d. Các khí Cl2, NH3, CO, CO2
Câu 18. Nhận biết các lọ mất nhãn chứa các chất sau:
a. Chất rắn BaSO4, BaCO3, NaCl, Na2CO3 (Chỉ dùng thêm HCl loãng)
b. Chất rắn NaCl, Na2SO4, BaCO3,Na2CO3 (chỉ dùng thêm CO2 và nước)
c. Các dung dịch NaOH, NH4Cl, Na2SO4, Na2CO3.
d. Bốn chất lỏng: H2O, HCl, Na2CO3, NaCl (không dùng thêm hóa chất nào khác)
Câu 19.
a. Phân biệt muối Na2CO3 và Na2SO3?
b. Phân biệt SiO2, Al2O3 và Fe2O3
Câu 19a.
a. Chỉ dùng một hoá chất phân biệt các dung dịch sau Na2CO3, Na2SO4, Na2SiO3, Na2S.
b. Không dùng hoá chất nào khác phân biệt các dd sau NaHCO3,CaCl2, Na2CO3, Ca(HCO3)2
Câu 20. Có một hỗn hợp khí gồm cacbon monooxit, hiđroclorua và lưu huỳnh đioxit. Bằng phương pháp hóa học hãy chứng minh sự có mặt của các khí trên trong hỗn hợp.
2. PHẢN ỨNG CỦA CO2 VỚI DUNG DỊCH KIỀM
Câu 21. Đốt cháy hoàn toàn 8g một mẫu than (gồm C và S) rồi cho sản phẩm cháy đi qua dung dịch NaOH dư thấy khối lượng bình tăng thêm 24g. Tính hàm lượng cacbon trong mẫu than
Câu 22. Khi đốt cháy hết 3,6g cacbon trong bình chứa 4,48 lít khí O2 (đktc) sinh ra một hỗn hợp khí gồm hai khí. Xác định % thể tích của hỗn hợp khí
Câu 23. Cho 224,0 ml CO2 (đktc) hấp thụ hết vào 100,0 ml dd KOH 0,200M. Tính khối lượng của các chất có trong dd tạo thành
Câu 24: Thể tích khí CO2 (đktc) nhiều nhất có thể bị hấp thụ bởi 150ml dung dịch NaOH 25% (d = 1,28 g/ml) là bao nhiêu?
Câu 25. Cho 25 gam CO2 vào 300 gam dung dịch KOH thu được 1,38 gam K2CO3 và một lượng muối KHCO3. Nồng độ phần trăm của dung dịch KOH đã dùng là bao nhiêu
....
SILIC VÀ HỢP CHẤT CỦA SILIC
Câu 1. Viết phương trình phản ứng giữa silic và dung dịch kiềm. Ngoài silic, có nguyên tố nào tác dụng với dd kiềm giải phóng khí H2?
Câu 2. Hoàn thành các phương trình hoá học sau (ghi rõ điều kiện phạn ứng nếu có)
a. Si + X2 (X: F, Cl, Br) → ? b. Si + O2 → ? c. Si + Mg → ?
d. Si + KOH + ? → ? e. SiO2 + NaOH → ?
Câu 3. Cho các chất sau: Si, SiO2, H2SiO3, Na2SiO3, Mg2Si. Hãy lập thành một dãy chuyển hoá giữa các chất trên và viết phương trình phản ứng.
Câu 4. Viết các phương trình hoá học theo sơ đồ sau đây
![]()
Câu 5. Từ SiO2 và các chất cần thiết khác, hãy viết các phương trình phản ứng hoá học để điều chế axit H2SiO3.
Câu 6. Để sản xuất loại thuỷ tinh thông thường, người ta nấu chảy một hỗn hợp gồm cát trắng (SiO2), đá vôi (CaCO3), sođa (Na2CO3) ở 1400OC. Khi đó tạo thành một hỗn hợp gồm các muối natri silicat và canxi silicat nóng chảy, để nguội được thuỷ tinh rắn. Hãy viết phương trình hoá học của các quá trình trên.
Câu 7. Thuỷ tinh loại thường (làm cửa kính, chai lọ, ...) được điều chế bằng cách nấu chảy một hỗn hợp gồm cát trắng, đá vôi, và sođa ở 1400OC. Viết phươg trình phản ứng tạo ra loại thuỷ tinh này.
Câu 8. Clanhke xi măng poolăng gồm các hợp chất canxi silicat Ca3SiO5, Ca2SiO4 và canxi aluminat Ca3(AlO3)2. Hãy biểu diễn công thức hoá học của các chất trên dưới dạng các oxit và tính phần trăm khối lượng của canxi oxit trong mỗi hợp chất.
Để tài đầy đủ trọn bộ câu hỏi bài tập chương Cacbon Silic các bạn ấn link TẢI VỀ phía dưới
......................................
Trên đây VnDoc đã giới thiệu tới các bạn Bài tập chương Cacbon - Silic. Để có thể nâng cao kết quả trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán 11, Chuyên đề Hóa học 11, Giải bài tập Hoá học 11. Tài liệu học tập lớp 11 mà VnDoc tổng hợp và đăng tải.
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, VnDoc mời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.









