Bài tập lập công thức phân tử hợp chất hữu cơ
Đây là tài liệu Cao cấp - Chỉ dành cho Thành viên VnDoc ProPlus.
- Tải tất cả tài liệu lớp 11 (Trừ Giáo án, bài giảng)
- Trắc nghiệm không giới hạn
Hóa học 11: Bài tập lập công thức phân tử hợp chất hữu cơ
Bài tập lập công thức phân tử hợp chất hữu cơ được VnDoc.com sưu tầm và đăng tải, tổng hợp lý thuyết và các dạng bài tập về xác định công thức phân tử hợp chất hữu cơ. Mời các bạn cùng theo dõi bài viết dưới đây nhé.
I. Xác định thành phần phần trăm khối lượng
CxHyOzNt (a gam) → mCO2 (g) + mH2O + VN2 (lít)
Ta có:
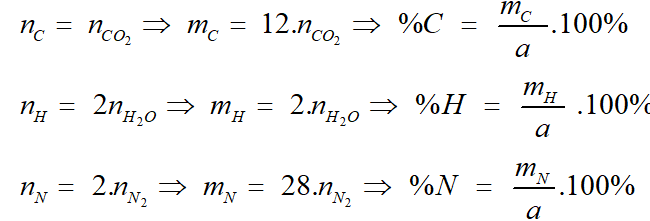
%O = 100% - %C - %H - %N
II. Lập công thức đơn giản nhất
Lập công thức đơn giản của hợp chất hữu cơ CxHyOzNt là tìm tỉ lệ:
x : y : z : t = nC : nH : nO : nN hoặc
![]()
III. Lập công thức phân tử hợp chất hữu cơ
1. Dựa vào phần trăm khối lượng các nguyên tố.
Xét sơ đồ: CxHyOz → xC + yH + zO
M (g) 12x (g) y (g) 16.z (g)
100% %C %H %O
Ta có tỉ lệ:
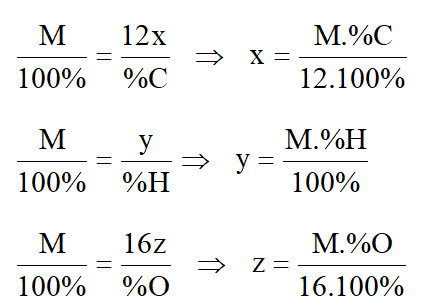
2. Thông qua công thức đơn giản nhất.
Hợp chất hữu cơ X có công thức đơn giản nhất CaHbOc thì CTPT có dạng (CaHbOc)n.
Dựa vào khối lượng mol phân tử của MX tính được n rồi suy ra CTPT của X.
Ví dụ: Chất hữu cơ X có CT ĐGN là CH2O và có khối lượng mol phân tử bằng 180,0 g/mol. Xác định CTPT của X.
Giải: CTPT của X là: (CH2O)n
Vậy: (12 + 2 + 16).n = 180 → n = 6. Vậy CTPT: C6H12O6
Nếu đề bài không cho M thì để tìm n ta phải biện luận như sau:
- Với CTTQ CxHyOz thì y ≤ 2x + 2, chẵn
- Với CTTQ CxHyOzNt thì y ≤ 2x + 2 + t
- Với CTTQ CxHyOzXu thì y ≤ 2x + 2 – u (X là halogen) y lẻ (chẵn) nếu t, u lẻ (chẵn)
3. Tính theo khối lượng sản phẩm đốt cháy.
Phản ứng đốt cháy:
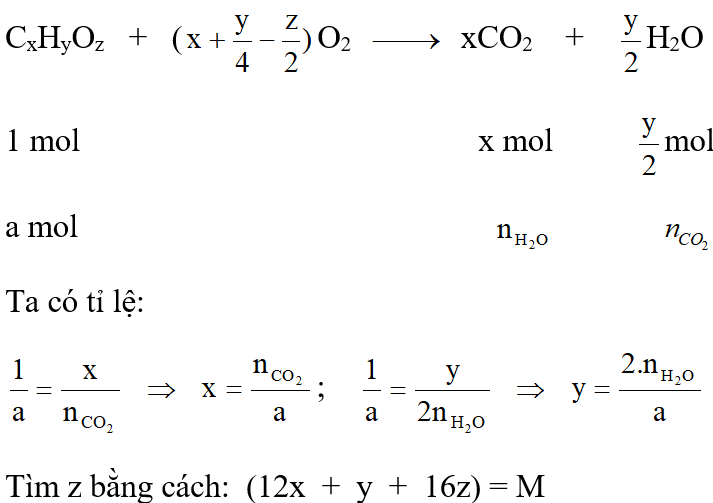
IV. Bài tập vận dụng.
Bài 1. Hãy thiết lập công thức đơn giản nhất từ các số liệu phân tích sau:
a) %C = 70,94%, %H = 6,40%, %N = 6,90%, còn lại là oxygen.
b) %C = 65,92%, %H = 7,75%, còn lại là oxi.
Đáp án hướng dẫn giải
a) CxHyOz
%O = 100% – ( 70,94 + 6,4 + 6,9) = 15,76%
Ta có x : y : z : t = 70,94/12/: 6,4/1:15,76/16:6,9/14 =5,91 : 6,40 : 0,99 : 0,49 = 12 : 13 : 2 : 1
Công thức đơn giản nhất: C12H13O2N
b) CxHyOz
%O = 100% – (65,92 + 7,75) = 26,33%
Ta có x : y : z = 65,92/12:7,75/1:26,33/16= 5,49 : 7,75 : 1,65 = 10 : 14 : 3
Công thức đơn giản nhất: C10H14O3
Bài 2. Hợp chất hữu cơ X có phần trăm khối lượng %C = 55,81%, %H = 6,98%, còn lại là oxygen.
a) Lập công thức đơn giản nhất của X
b) Tìm CTPT của X. Biết tỉ khối hơi của X so với nitrogen xấp xỉ bằng 3,07
Đáp án hướng dẫn giải chi tiết
Công thức phân tử của X là CxHyOz
Xét tỉ lệ x : y : z = %C/12 : %H/1 : %O/16 = 2 : 3: 1
X là công thức đơn giản nhất là C2H3O → CTPT của X có dạng (C2H3O)n
MX = 28.3,07 = 86,00 (g/mol)
⇒ 43n = 86 nên n = 2.
CTPT của X:C4H6O2
Bài 3. Từ tinh dầu hồi, người ta tách được Anethol -một chất thơm được dùng sản xuất kẹo cao su. Anethol có khối lượng mol phân tử bằng 148,0 g/mol. Phân tích nguyên tố cho thấy, Anethol có %C = 81,08%; %H = 8,10%, còn lại là oxygen. Lập công thức đơn giản nhất và CTPT của Anethol.
Đáp án hướng dẫn giải
%O = 100% - 81,08% - 8,1% = 10, 82%
x : y : z = 81,08/12:8,1/1: 10,82/16 = 6,76: 8,1: 0,676
=> Công thức đơn giản nhất là C10H12O
=> (C10H12O)n = 148 => n = 1
=> CTPT: C10H12O
Bài 4. Đốt cháy hoàn toàn 9,0 gam hợp chất hữu cơ A (chứa C, H, O) thu được 7,437lít CO2 (đktc) và 5,4 gam H2O.
a) Tính thành phần phần trăm của các nguyên tố trong A.
b) Lập công thức đơn giản nhất của A.
c) Tìm công thức phân tử của A. Biết tỉ khối hơi của A so với khí oxygen bằng 1,875.
Đáp án hướng dẫn giải
nCO2 = 7,437/24,79= 0,3 mol;
nH2O = 5,4/18=0,3mol
Đốt cháy A chỉ thu được CO2 và H2O nên A chứa C, H và có thể có O.
Bảo toàn nguyên tố C, H ta có
nC(A) = nCO2 = 0,3 mol
nH(A) = 2nH2O = 0,6 mol
Ta có:
mO = mA−mC−mH = 9 − 0,3.12 − 0,6.1 = 4,8 gam
→ nO = 4,8/16 = 0,3 mol
Thành phần phần trăm các nguyên tố trong A là:
%C = (0,3.12/9).100% = 40%
%H = (0,6.1/9).100% = 6,67%
%O = (4,8/9).100% = 53,33%
b.
Ta có: nC : nH : nO = 0,3 : 0,6 : 0,3 = 1 : 2 : 1
Công thức đơn giản nhất của A là: CH2O
c.
Công thức phân tử của A có dạng: (CH2O)n
Ta có: dA/O2 = 1,875 →MA = 1,875.32 = 60
→(12 + 2 + 16).n = 16 → n = 2
Vậy công thức phân tử của A là: C2H4O2
Bài 5. Đốt cháy hoàn toàn 5,75 gam hợp chất hữu cơ X (chứa C, H, O) thu được 11,0 gam CO2 và 6,75 gam H2O.
a) Tính thành phần phần trăm của các nguyên tố trong X.
b) Lập công thức đơn giản nhất của X.
c) Tìm công thức phân tử của X. Biết tỉ khối hơi của X so với khí hiđro bằng 23.
Đáp án hướng dẫn giải chi tiết
Ta có
nC = nCO2 = 0,25
![]()
nH = 2nH2O = 0,75
![]()
⇒ %O = 100% -%H - %C = 34,79%
![]()
X là CxHyOz
⇒ x : y : z = nC : nH : nO = 0,25 : 0,75 : 0,125 = 2 : 6 : 1
Công thức đơn giản nhất: C2H6O
Công thức phân tử: (C2H6O )n
⇒ MX = 46n = 23,2
⇒ n = 1
Công thức hóa học X là C2H6O
VI. Câu hỏi bài tập trắc nghiệm
Câu 1. Đốt cháy hoàn toàn m(g) chất hữu cơ A chứa C, H, O khối lượng sản phẩm cháy là p(g). Cho toàn bộ sản phẩm này qua dung dịch nước vôi trong có dư thì sau cùng thu được t gam kết tủa, biết p = 0,71t và t = (m + p)/1,02. Xác định CTPT của A?
A. C2H6O2
B. C2H6O
C. C3H8O3
D. C3H8O
Đặt t = 1 gam
Ta có:
p= 0,71
![]()
Đặt công thức là CxHyOz
CxHyOz + O2→ CO2 + H2O
nCaCO3 = 1/100 = 0.01 = nCO2 → mCO2 = 0,44, mC=0,12
→ mH2O = 0,71 - 0,4 = 0 ,27
→ nH2O = 0,015
→ mH = 0,03
mO=0,31-0,12-0,03 = 0,16 ⇒ nO=0,01
x : y : z = nC:nH:nO = 0,01:0,03:0,01
→ CTPT: C2H6O2
Câu 2. ĐĐốt cháy hoàn toàn 0,01 mol chất hữu cơ X cần vừa đủ 0,681725 lít O2. Sau thí nghiệm thu được hỗn hợp sản phẩm Y gồm: CO2, N2 và hơi H2O. Làm lạnh để ngưng tụ hơi H2O chỉ còn 0,61975 lít hỗn hợp khí Z (có tỉ khối hơi với H2 là 20,4). Xác định công thức phân tử X. Biết thể tích các khí đều đo ở đkc.
A. C2H5ON
B. C2H5O2N
C. C2H7ON
D. C2H7O2N
Gọi số mol của CO2 là x và N2 là y
nZ = 0,61975/24,79 = 0,025 mol
⇒ x + y = 0,025 (1)
Mà MZ = 20,4.2 = 40,8 ⇒ mZ = 40,8.0,025 = 1,02 gam
44x + 28y = 1,02 (2)
Từ (1) và (2) ta giải hệ phương trình được:
⇒ x = 0,02, y = 0,005
⇒ có 2 C và 1 N trong X
Gọi CTPT của X là C2HaObN
nO2 = 0,616/22,4 = 0,0275 mol
C2HaObN + ( 2+ 0,25a - 0,5b)O2 → 2CO2 + 0,5N2 + 0,5a H2O
=> 2+ 0,25a - 0,5b = 2,75 => a = 7 và b = 2
=> C2H7O2N
Câu 3. Đốt cháy hoàn toàn 1,12g chất hữu cơ A, rồi cho hấp thụ toàn bộ sản phẩm cháy trong dung dịch Ba(OH)2 dư thấy khối lượng bình chứa tăng 3,36g. Biết rằng số mol CO2 gấp 1,5 lần số mol của nước. CTPT của A là: (biết A có 1 nguyên tử oxygen trong phân tử)
A. C3H8O
B. CH2O
C. C4H10O
D. C3H4O
Gọi công thức phân tử của A là CxHyOz (z ≥ 0z ≥ 0).
Có 44nCO2 + 18nH2O = 3,36
nCO2 = 1,5nH2O => nH2O = 0,04 mol; nCO2 = 0,06 mol
=> nC(A) = nCO2 = 0,06 mol
nH(A) = 2nH2O = 0,08 mol
=> x: y: z = 0,06: 0,08: 0,02 = 3:4:1
=> A có dạng (C3H4O)
Mà MA < 30.2 = 60 nên 56n < 60 => n = 1
Vậy công thức phân tử của A là C3H4O
Câu 4. Khi phân tích a(g) chất hữu cơ A chứa C, H, O thấy tổng khối lượng 2 nguyên tố carbon và hydrogen là 0,46g. Nếu đốt cháy hoàn toàn a(g) chất A cần vừa đủ 0,9916 lít O2 (ở đkc). Cho toàn bộ sản phẩm cháy qua bình chứa dung dịch NaOH dư, thấy chúng bị hấp thụ hoàn toàn và khối lượng bình chứa tăng thêm 1,9g. Công thức phân tử của A là
A. C6H6O2
B. C6H6O
C. C7H8O
D. C7H8O2
nO2 = 0,04 mol
Áp dụng bảo toàn khối lượng ta có mA + mO2 = mCO2 + mH2O
Suy ra mA = 1,9 – 0,04.32 = 0,62 g
mC + mH + mO = 0,62 → mO = 0,16 g → nO = 0,01 mol
Áp dụng bảo toàn nguyên tố nO (A) + nO (O2) = nO (CO2) + nO (H2O)
Suy ra 2.nCO2 + nH2O = 0,04.2 + 0,01 = 0,09 mol
Mặt khác mC + mH =0,46 g
Suy ra nCO2 = 0,035 mol , nH2O =0,02 mol suy ra nC = 0,035 mol, nH = 0,04
nC : nH : nO = 0,035 : 0,04 : 0,01 = 7: 8: 2
Công thức phân tử của A là C7H8O2
Câu 5. Đốt cháy 0,45g chất hữu cơ A rồi cho toàn bộ sản phẩm qua bình đựng nước vôi trong dư thì có 112 cm3 N2 (đkc) thoát ra khỏi bình, khối lượng bình tăng 1,51g và có 2g kết tủa trắng.Công thức phân tử của A là :
A. C4H14N2
B. C2H7N
C. C2H5N
D. Không xác định được
nN2 = 0,005 ⇒ nN = 0,01
nCO2 = nCaCO3 = 0,02⇒ nC = 0,02
mCO2 + mH2O = 1,51 ⇒ nH2O = 0,035 ⇒ nH = 0,07
nO = (mA – mC – mH – mN)/16 = 0
C : H : N = 2 : 7 : 1 ⇒ C2H7N
📥Mời các bạn tải File đầy đủ về tham khảo!











