Hóa 11 bài 8: Amoniac và muối amoni
Amoniac và muối amoni
Hóa 11 bài 8: Amoniac và muối amoni được VnDoc biên soạn tổng hợp lại là các nội dung chính trong bài 8 Hóa 11, hy vọng giúp ích cho các bạn học sinh trong quá trình ôn luyện ghi nhớ kiến thức hóa học 11 bài 8. Mời các bạn tham khảo nội dung chi tiết dưới đây.
A. Amoniac
I. Cấu tạo phân tử
Trong phân tử amoiac: nguyên tử N liên kết với H bằng liên kết cộng hóa trị có cực.
Phân tử NH3 có cấu tạo hình chóp với nguyên với nguyên tử N ở đỉnh.Đáy là một tam giác mà đỉnh là ba nguyên tử H.
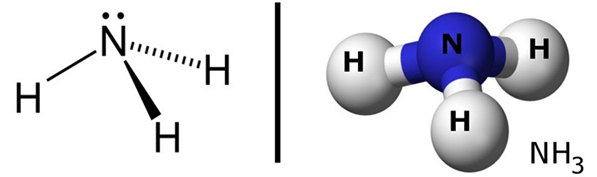
Nguyên tử N có cặp electron hóa trị tham gia liên kết với nguyên tử khác.
II. Tính chất vật lí
Amoniac là chất khí không màu, có mùi khai và sốc, nhẹ hơn không khí.
Khí amoniac tan nhiều trong nước
III. Tính chất hóa học
1. Tính bazơ yếu
a) Tác dụng với H2O
NH3 kết hợp với H+ của nước , tạo thành ion amoni NH4+, giải phóng OH- và dẫn điện
NH3 + H2O ![]() \(\overset{}{\rightleftharpoons}\) NH4+ + OH-
\(\overset{}{\rightleftharpoons}\) NH4+ + OH-
Trong dung dịch, Amoniac là bazơ yếu. Có thể làm quỳ tím ẩm chuyển thành màu xanh.
b) Tác dụng với dung dịch muối
Dung dịch amoniac tác dụng với dung dịch muối của nhiều kim loại tạo thành kết tủa hiđroxit.
Thí dụ:
AlCl3 + 2NH3 + 3H2O → Al(OH)3 + 3NH4Cl
c) Tác dụng với axit
Khí amoniac cũng như dung dịch amoniac tác dụng với axit tạo muối amoni
NH3 + HCl → NH4Cl
NH3 + H2SO4 → (NH4)2SO4
NH3 + HNO3 → NH4NO3
2. Tính khử
Trong phân tử NH3 nguyên tử N có số oxi hóa là -3 là số oxi hóa thấp nhất vì vậy amoniac có tính khử.
a) Tác dụng với oxi
4N-3H3 + 3O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2N20 + 6H2O
\(\overset{t^{\circ } }{\rightarrow}\) 2N20 + 6H2O
Amoniac cháy trong oxi cho ngọn lửa màu vàng, tạo ra khí nitơ và hơi nước
b) Tác dụng với clo
2NH3 + 3Cl2 → N2 + 6HCl
Đông thời NH3 kết hợp ngay với HCl tạo thành khói trắng NH4Cl
III.Tính chất vật lí và ứng dụng
Amoniac là chất khí không màu, mùi khai và sốc, nhẹ hơn không khí, tan nhiều trong nước.
Amoniac được sử dụng chủ yếu để sản xuất axit nitric, phân đạm làm nhiên liệu điều chế tên lửa, làm chất làm lạnh.
IV. Điều chế
1. Trong phòng thí nghiệm
2NH4Cl + Ca(OH)2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CaCl2 + 2NH3 + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) CaCl2 + 2NH3 + 2H2O
2. Trong công nghiệp
N2 + 3H2 ![]() \(\overset{xt, t^{\circ } , p}{\rightleftharpoons}\) 2NH3 ΔH < 0
\(\overset{xt, t^{\circ } , p}{\rightleftharpoons}\) 2NH3 ΔH < 0
B. MUỐI AMONI
Muối amoni là chất tinh thể ion, gồm cation amoni NH4+ và anion gốc axit.
Thí dụ: NH4Cl (amoni clorua),....
I. Tính chất vật lí
Tất cả các muối amoni đều tan nhiều trong nước, khi tan điện li hoàn toàn tạo thành các ion.
II. Tính chất hóa học
1. Tác dụng với dung dịch kiềm
Dung dịch đậm đặc muối amoni + dung dịch kiềm → khí amoniac
Thí dụ
NH4Cl + NaOH ![]() \(\overset{t^{\circ } }{\rightarrow}\) NH3 + NaCl + H2O
\(\overset{t^{\circ } }{\rightarrow}\) NH3 + NaCl + H2O
=> Đây là phản ứng nhận biết ion amoni.
2. Phản ứng nhiệt phân
Muối amoni chứa gốc axit không có tính oxi hóa.
Thí dụ
(NH4)2CO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2NH3 + CO2 + H2O
\(\overset{t^{\circ } }{\rightarrow}\) 2NH3 + CO2 + H2O
Muối amoni chứa gốc của axit có tính oxi hóa.
Thí dụ
NH4NO2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) N + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) N + 2H2O
NH4NO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) N2O + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) N2O + 2H2O
B. Giải bài tập hóa 11 bài 8 Amoniac và muối amoni
Để giúp bạn đọc hoàn thành tốt các dạng bài tập hóa 11 bài 8 Amoniac và muối amoni sách giáo khoa. Cũng như giúp củng cố, rèn luyện thêm các thao tác kĩ năng giải bài tập của từng bài. VnDoc đã biên soạn hướng dẫn giải chi tiết bài tập sách giáo khoa hóa 11 bài 8 Amoniac và muối amoni tại: Giải bài tập Hóa 11 bài 8: Amoniac và muối amoni
C. Trắc nghiệm hóa 11 bài 8 Amoniac và muối amoni
Các bạn học sinh đã được làm quen các dạng bài tập câu hỏi hóa 11 bài 8 Amoniac và muối amoni dưới dạng bài tập tự luận ở sách giáo khoa cũng như sách bài tập. Ngoài ra để nâng cao, củng cố kiến thức cũng như dạng câu hỏi. VnDoc đã biên soạn bộ câu hỏi trắc nghiệm hóa 11 bài 8 Amoniac và muối amoni có đáp án, hướng dẫn giải chi tiết tại: Trắc nghiệm Hóa học 11 bài 8: Amoniac và muối amoni
.............................................................
Trên đây VnDoc.com vừa giới thiệu tới các bạn bài viết Hóa 11 bài 8: Amoniac và muối amoni, mong rằng qua bài viết này các bạn có thể học tập tốt hơn môn Hóa học lớp 11. Mời các bạn cùng tham khảo thêm kiến thức các môn Toán 11, Ngữ văn 11, Tiếng Anh 11, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11...
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, VnDoc mời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.









