Hóa 11 Bài 13 Luyện tập: Tính chất của nito, photpho và các hợp chất của chúng
Hóa 11 Bài 13 Luyện tập: Tính chấtt của nito, photpho và các hợp chất của chúng được VnDoc biên soạn là nội dung ôn tập bài 13 hóa 11. Giúp các bạn hệ thống lại toàn bộ các kiến thức chương 2. Từ đó vận dụng giải các bài tập sách giáo khoa, sách bài tập. Mời các bạn tham khảo.
Luyện tập Tính chất của nito, photpho và các hợp chất của chúng
A. Tóm tắt nội dung Hoá 11 bài 13
I. NITO
Cấu hình electron N (Z=7): 1s22s22p3
=> Vị trí ô thứ 7, chu kì 2 nhóm VA trong bảng tuần hoàn.
Số oxi hóa có thể có: -3; + 1; +2; +3; +4; +5
1. Cấu tạo và tính chất:
Cấu tạo: N≡N → N2 rất bền
Ở điều kiện thường N2 là chất khí không màu, không mùi, không vị, không duy trì sự cháy sự hô hấp.
Nhiệt độ thường N2 khá trơ về mặt hóa học
Nhiệt độ cao, N2 vừa thể hiện tính chất oxi hóa vừa thể hiện tính khử
Tính oxi hóa: No2 + 3Mg ![]() \(\overset{t^{\circ } }{\rightarrow}\) Mg3N-32
\(\overset{t^{\circ } }{\rightarrow}\) Mg3N-32
Tính khử: No2 + O2 ![]() \(\overset{t^{\circ },xt }{\rightarrow}\) 2N+2O
\(\overset{t^{\circ },xt }{\rightarrow}\) 2N+2O
2. Điều chế:
Trong công nghiệp: Chưng cất phân đoạn không khí lỏng.
Trong PTN: NH4Cl + NaNO2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) NaCl + N2 + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) NaCl + N2 + 2H2O
II. AMONIAC (NH3)
1. Cấu tạo: NH3 là phân tử có cực, có cấu tạo hình chóp
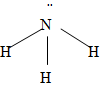
2. Tính chất vật lý:
Chất khí không màu, có mùi khai và sốc, nhẹ hơn không khí thu khí NH3 bằng phương pháp đẩy không khí (úp ngược bình).
Tan rất nhiều trong nước tạo thành dung dịch NH3 không thu bằng phương pháp dời chỗ của nước.
3. Tính chất hóa học:
Trong phân tử NH3 còn đôi electron tự do => Có khả năng cho e => NH3 có tính bazo.
Ngoài ra trong NH3 nito có số oxi hóa -3 thấp nhất => thể hiện tính khử.
Tính bazo yếu:
NH3 + H2O ![]() \(\overset{}{\rightleftharpoons}\) NH4+ + OH- (NH3 làm quỳ ẩm chuyển sang màu xanh)
\(\overset{}{\rightleftharpoons}\) NH4+ + OH- (NH3 làm quỳ ẩm chuyển sang màu xanh)
NH3 + HCl → NH4Cl
3NH3 + 3H2O + AlCl3 → 3NH4Cl + Al(OH)3
Tính tạo phức: dung dịch NH3 có khả năng hòa tan hidroxit hay muối ít tan của một số kim loại (Ag, Cu, Zn)
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
2NH3 + AgCl → [Ag(NH3)2]Cl
Tính khử:
2N-3H3 + 3Cl2 → No2 + 6HCl
2N-3H3 + 3CuO → No2 + 3H2O + 3Cu
4. Điều chế:
Cho muối amoni tác dụng với dung dịch bazo
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
III. MUỐI AMONI (NH4Cl, NH4NO3, (NH4)2SO4...)
Tác dụng với dung dịch kiềm
NH4+ + OH- → NH3 + H2O (phản ứng này dùng để nhận biết ion NH4+)
Phản ứng nhiệt phân: Các muối amoni dễ bị nhiệt phân
Muối amoni mà gốc axit không còn khả năng oxi hóa nhiệt phân tạo NH3:
(NH4)2CO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2NH3 + CO2 + H2O
\(\overset{t^{\circ } }{\rightarrow}\) 2NH3 + CO2 + H2O
Muối amoni mà gốc axit có khả năng oxi hóa nhiệt phân tạo N2 hoặc N2O:
NH4NO2 → N2 + 2H2O
NH4NO3 → N2O + 2H2O
IV. AXIT NITRIC (HNO3)
1. Tính axit mạnh
Làm đỏ quỳ tím
Tác dụng với bazo, oxit bazo, muối
2. Tính oxi hóa mạnh: HNO3 oxi hóa hầu hết các kim loại kể cả những kim loại đứng sau H như Cu, Ag (trừ Pt, Au), oxi hóa kim loại lên số oxi hóa dương cao nhất, oxi hóa nhiều phi kim và hợp chất.
Sản phẩm khử: thông thường là NO ngoài ra còn có thể là NO2, N2, N2O, (NH4NO3)
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
S + 2HNO3 → H2SO4 + 2NO
Fe, Al, Cr thụ động với HNO3 đặc, nguội
3. Điều chế
Trong PTN: NaNO3 tt + H2SO4 đặc → NaHSO4 + HNO3
Trong công nghiệp: NH3 ![]() \(\overset{+O_{2} }{\rightarrow}\) NO
\(\overset{+O_{2} }{\rightarrow}\) NO ![]() \(\overset{+O_{2} }{\rightarrow}\) NO2
\(\overset{+O_{2} }{\rightarrow}\) NO2 ![]() \(\overset{+O_{2}+H_{2}O }{\rightarrow}\) HNO3
\(\overset{+O_{2}+H_{2}O }{\rightarrow}\) HNO3
V. MUỐI NITRAT (Chứa ion NO3-)
1. Tính chất hóa học
Dễ bị phân hủy bởi nhiệt
![]()
Nhóm I nhiệt phân tạo muối nitro và O2: Ví dụ: 2KNO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KNO2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) 2KNO2 + O2
Nhóm II nhiệt phân tạo oxit, NO2 và O2: Ví dụ: 2Cu(NO3)2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2CuO + 4NO2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) 2CuO + 4NO2 + O2
Nhóm III nhiệt phân tạo kim loại, NO2 và O2: Ví dụ: 2AgNO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Ag + 2NO2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) 2Ag + 2NO2 + O2
Nhận biết ion NO3-: Sử dụng: Cu + H2SO4 (hoặc HCl)
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O (xuất hiện dung dịch xanh lam và khí không màu hóa nâu)
2. Ứng dụng
Thuốc nổ đen (thuốc nổ có khói): KNO3 + S + C
VI. PHOTPHO
1. Tính chất vật lí
Photpho trắng: Rất độc, gây bỏng nặng khi rơi vào da, ở nhiệt độ thường phát quang màu lục nhạt trong bóng tối, bốc cháy trong không khí ở nhiệt độ >40oC
Photpho đỏ: Là chất bột màu đỏ, dễ hút ẩm và cháy rữa, cấu trúc polime → khó nóng chảy và khó bay hơi hơn photpho trắng, không tan trong các dung môi thông thường, bền trong không khí ở nhiệt độ thường, bốc cháy ở nhiệt độ >250oC
P trắng ![]() \(\overset{250^{\circ }C }{\rightarrow}\) P đỏ
\(\overset{250^{\circ }C }{\rightarrow}\) P đỏ
2. Tính chất hóa học
Photpho hoạt động hóa học mạnh hơn nito
a. Tính oxi hóa
P + kim loại hoạt động → photphua kim loại
P + Ca ![]() \(\overset{t^{\circ }}{\rightarrow}\) Ca3P (Canxi photphua)
\(\overset{t^{\circ }}{\rightarrow}\) Ca3P (Canxi photphua)
b. Tính khử
Tác dụng với oxi
4P + 3O2 thiếu ![]() \(\overset{t^{\circ }}{\rightarrow}\) 2P2O3
\(\overset{t^{\circ }}{\rightarrow}\) 2P2O3
4P + 5O2 ![]() \(\overset{t^{\circ }}{\rightarrow}\) 2P2O5
\(\overset{t^{\circ }}{\rightarrow}\) 2P2O5
Tác dụng với halogen
2P + 3Cl2 → 2PCl3
2P + 5Cl2 thiếu ![]() \(\overset{t^{\circ }}{\rightarrow}\) 2PCl5
\(\overset{t^{\circ }}{\rightarrow}\) 2PCl5
Tác dụng với hợp chất (HNO3 đặc, KClO3, KNO3, K2Cr2O7,...)
6P + 5KClO3 ![]() \(\overset{t^{\circ }}{\rightarrow}\) 3P2O5 + 5KCl
\(\overset{t^{\circ }}{\rightarrow}\) 3P2O5 + 5KCl
P + 5HNO3 ![]() \(\overset{t^{\circ }}{\rightarrow}\) H3PO4 + 5NO2 + H2O
\(\overset{t^{\circ }}{\rightarrow}\) H3PO4 + 5NO2 + H2O
3. Ứng dụng
Sản xuất axit photphoric
Sản xuất diêm, brom, đạn....
4. Trạng thái tự nhiên:
Dạng muối photphoric như apatit 3Ca3(PO4)2.CaF2, photphotrit Ca3(PO4)2
5. Sản xuất
Ca3(PO4)2 + 3SiO2 + 5C ![]() \(\overset{120^{\circ }C}{\rightarrow}\) 3CaSiO3 + 2P + 5CO
\(\overset{120^{\circ }C}{\rightarrow}\) 3CaSiO3 + 2P + 5CO
VII. AXIT PHOTPHORIC (H3PO4)
1. Tính chất vật lí
Là chất rắn dạng tinh thể, trong suốt, không màu, rất háo nước => dễ chảy rữa
Axit photphoric thường dùng là dung dịch đặc, sánh
2. Tính chất hóa học
a. Tính oxi hóa khử
Photpho có mức oxi hóa +5 bên hơn nito => H3PO4 khó bị khử => không có tính oxi hóa như axit HNO3
b. Tính axit
Axit H3PO4 là axit ba lần axit, có độ mạnh trung bình => có đầy đủ tính chất chung của axit
Tác dụng với bazo: Sản phẩm tạp thành phụ thuộc vào X
Đặt X = nNaOH/nH3PO4
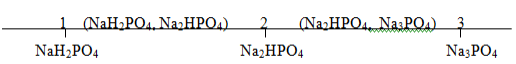
3. Điều chế
Trong phòng thí nghiệm: P + 5HNO3 đặc ![]() \(\overset{t^{\circ } }{\rightarrow}\) H3PO4 + 5NO2 + H2O
\(\overset{t^{\circ } }{\rightarrow}\) H3PO4 + 5NO2 + H2O
Trong công nghiệp: Ca3(PO4)2 + 3H2SO4 đặc ![]() \(\overset{t^{\circ } }{\rightarrow}\) 3CaSO4 + 2H3PO4
\(\overset{t^{\circ } }{\rightarrow}\) 3CaSO4 + 2H3PO4
=> H3PO4 không tinh khiết, có chất lượng thấp
P ![]() \(\overset{t^{\circ } }{\rightarrow}\) P2O5 → 2H3PO4 => H3PO4 có độ tinh khiết và nồng độ cao
\(\overset{t^{\circ } }{\rightarrow}\) P2O5 → 2H3PO4 => H3PO4 có độ tinh khiết và nồng độ cao
B. Giải Hóa 11 bài 13
VnDoc đã hướng dẫn giải chi tiết đầy đủ các dạng bài tập SGK Hóa 11 bài 13 tại: Giải Hóa 11 Bài 13: Luyện tập tính chất của nitơ, photpho và các hợp chất của chúng
C. Giải SBT Hóa 11 bài 13
Mời các bạn xem hướng dẫn giải chi tiết bài tập SBT Hóa 11 bài 13 tại:Giải bài tập Hóa học 11 SBT bài 13
.........................................
Trên đây VnDoc đã giới thiệu tới các bạn Hóa 11 Bài 13 Luyện tập: Tính chât của nito, photpho và các hợp chất của chúng. Để có thể nâng cao kết quả trong học tập mời các bạn tham khảo một số tài liệu: Hóa học lớp 10, Giải bài tập Hóa học lớp 11, Thi thpt Quốc gia môn Văn, Thi thpt Quốc gia môn Lịch sử, Thi thpt Quốc gia môn Địa lý, Thi thpt Quốc gia môn Toán, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11 mà VnDoc tổng hợp và đăng tải.
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, VnDoc mời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.









