Những chất làm mất màu KMnO4
Chúng tôi xin giới thiệu bài Những chất làm mất màu KMNO4 được VnDoc biên soạn tổng hợp giúp bạn học có thể xác định được các chất có khả năng làm mất màu dung dịch thuốc tím KMnO4.
KMnO4 có thể oxi hóa hợp chất hữu cơ ở các môi trường
I. Hợp chất hữu cơ
1. Hydrocarbon no (Alkanen, Cycloalkane)
Không làm mất màu dung dịch KMnO4.
2. Hydrocarbon không no (Alkene, Alkadiene, Alkyne)
Các Alkene, Alkadiene, Alkyne có khả năng làm mất màu dung dịch thuốc tím, đây là phản ứng oxi hoá không hoàn toàn.
- Alkene (có công thức tổng quát CnH2n với n ≥ 2 )
Ví dụ
3CH2 = CH2 + 2KMnO4 + 4H2O → 3HO – CH2 – CH2 – OH + 2MnO2 + 2KOH
Ethylene
Phản ứng oxi hoá không hoàn toàn alkene được ứng dụng để sản xuất các dẫn xuất chứa oxygen của hydrocarbon trong công nghiệp.
- Alkyne (có công thức tổng quát CnH2n - 2 với n ≥ 2 )
Ví dụ
3C2H2 + 8KMnO4 → 3(COOK)2 + 8MnO2 ↓ + 2KOH + 2H2O
MnO2 là chất kết tủa có màu nâu đen.
3. Arene (Hydrocarbon thơm)
Arene hay còn gọi là hydrocarbon thơm là những hydrocarbon trong phân tử có chứa một hay nhiều vòng benzene.
Benzene và toluene đều không tác dụng với dung dịch KMnO4 ở điều kiện thường.
Các alkylbenzene có thể bị oxi hoá bởi dung dịch KMnO4 khi đun nóng
+ Toluen làm mất màu dung dịch KMnO4 ở điều kiện nhiệt độ 80-100oC
C6H5–CH3 + 2KMnO4 ![]() C6H5–COOK + 2MnO2↓ + KOH + H2O
C6H5–COOK + 2MnO2↓ + KOH + H2O
(Toluene)
+ Styrene làm mất màu dung dịch KMnO4 và bị oxi hóa ở nhóm vinyl (giống như ethylene) nên phản ứng xảy ra ngay nhiệt độ thường.
3C6H5-CH=CH2 + 10KMnO4 → 3C6H5COOK + 3K2CO3 + 10MnO2 + KOH + 4H2O
(Styrene)
+ Cumene làm mất màu dung dịch KMnO4
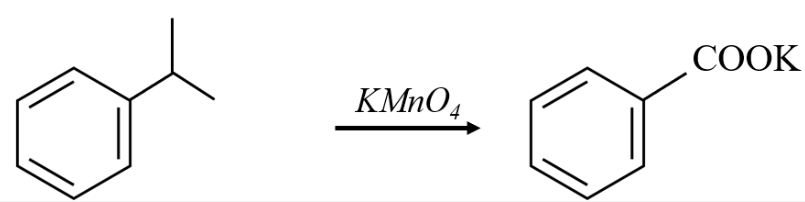
(Cumene)
4. Hợp chất carbonyl
Formaldehyde khả năng gây mất màu dung dịch thuốc tím
HCHO + KMnO4 → HCOOK + H2O + MnO2
II. Hợp chất vô cơ
Dung dịch làm mất màu KMnO4 thường là dung dịch chứa chất khử mạnh có khả năng khử Manganese từ Mn7+ về Mn2+. Một số chất thông thường được sử dụng là:
H2SO3: Sulfurous acid là một chất khử mạnh, tạo ra SO2 làm mất màu KMnO4.
H2S: Khí Hydro sulfide (khí sunfurua) là một chất khử mạnh, tạo ra S2- làm mất màu KMnO4
(NH4)2SO3: khử tương tự như H2SO3.
Fe2+ hoặc Sn2+: ion sắt (II) hoặc ion thiếc (II) là các chất khử mạnh, tạo ra ion sắt(III) hoặc ion thiếc(IV) làm mất màu KMnO4.
III. Tính chất hóa học của KMnO4
KMnO4 có tính oxi hóa mạnh do Mn có số oxi hóa +7 cực đại. Tính oxi hóa của KMnO4 còn phụ thuộc vào môi trường tiến hành phản ứng, thông thường tính oxi hóa của KMnO4 mạnh nhất trong môi trường acid, sau đó là môi trường trung tính và cuối cùng là môi trường base.
Trong môi trường acid: KMnO4 bị khử thành Mn có số oxi hóa +2. Nó có khả năng oxi hóa được các halogenua (trừ F-), các muối sulfua tan và H2S, H nguyên tử và các chất hữu cơ và các chất khử khác.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
4KMnO4 + 5C2H5OH + 6H2SO4 → 5CH3COOH + 2K2SO4 + 4MnSO4 + 11H2O
2KMnO4 + 10KI + 8H2SO4→ 6K2SO4 + 2MnSO4 + 5I2 + 8H2O
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + 6K2SO4 + 2MnSO4 + 8H2O
2KMnO4 + 5H2C2O4 + 3H2SO4 → 10CO2 + K2SO4 + 2MnSO4 + 8H2O
Trong môi trường trung tính: KMnO4 bị khử thành Mn có số oxi hóa +4 (MnO2). KMnO4 có thể oxi hóa được H2S, ethanol …
2KMnO4 + 3H2S → 2MnO2 + 3S + 2KOH + 2H2O
2KMnO4 + 3CH3CH2OH → 2MnO2 + 3CH3CHO + 2KOH + 2H2O
Trong môi trường base: KMnO4 bị khử thành Mn có số oxi hóa + 6
2KMnO4 + K2SO3 + 2KOH → 2K2MnO4 + K2SO4 + H2O
2KMnO4 + KCN + 2KOH → 2K2MnO4 + KOCN + H2O
Trong điều kiện nhiệt độ cao: KMnO4 tự phân hủy sinh ra oxi, ngoài ra nó oxi hóa mạnh nhiều phi kim và các chất khử các
2KMnO4 ![]() K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
2KMnO4 + C ![]() K2MnO4 + MnO2 + CO2
K2MnO4 + MnO2 + CO2
2KMnO4 + S ![]() K2MnO4 + MnO2 + SO2
K2MnO4 + MnO2 + SO2
10KMnO4 + 4P ![]() 5K2MnO4 + 5MnO2 + 2P2O5
5K2MnO4 + 5MnO2 + 2P2O5
-------------------------------------------









