pH của dung dịch HCL 10 mũ trừ 2 M
Chúng tôi xin giới thiệu bài pH của dung dịch HCL 10 mũ trừ 2 M được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
pH của dung dịch HCl 10-2 M
Câu hỏi: pH của dung dịch HCl 10-2 M là:
- 3
- 4
- 2
- 5
Lời giải:
Đáp án C
pH = -log(H+) = 2
I. Thuyết axit - bazơ của A-rê-ni-út
Axit là chất khi tan trong nước phân li ra ion H+
Bazơ là những chất khi tan trong nước phân li ra ion OH-
Hiđroxit lưỡng tính khi tan trong nước vừa có thể phân li như axit vừa phân li như bazơ.
Hầu hết các muối khi tan trong nước, điện li hoàn toàn ra cation kim loại (hoặc cation NH4+) và anion gốc axit.
Nếu gốc axit còn chứa hiđro có tính axit, thì gốc đó điện li yếu ra cation H+ và anion gốc axit.
Một vài lưu ý cần nhớ:
- Axit khi tan trong nước phân li ra ion H+.
Bazơ khi tan trong nước phân li ra ion OH−.
Hiđroxit lưỡng tính khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
Hầu hết các muối khi tan trong nước phân li hoàn toàn ra cation kim loại (hoặc cation NH+) và anion gốc axit.
Nếu gốc axit còn chứa hiđro có tính axit, thì gốc đó tiếp tục phân li yếu ra cation H+ và anion gốc axit.
Tích số ion của nước là
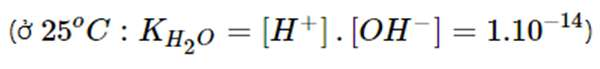
Một cách gần đúng, có thể coi giá trị của tích số này là hằng số cả trong dung dịch loãng của các chất khác nhau.
Các giá trị [H+] và pH đặc trưng cho các môi trường:
- Môi trường trung tính:
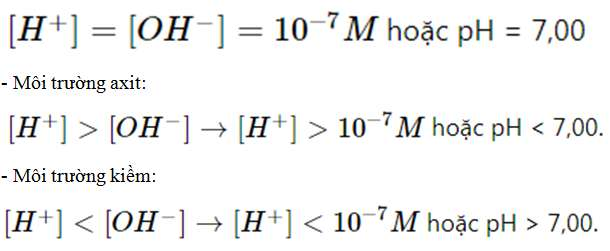
Màu của quỳ, phenolphtalein và chất chỉ thị vạn năng trong dung dịch ở các giá trị pH khác nhau.
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau:
- chất kết tủa.
- chất điện li yếu.
- chất khí.
Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li.
Trong phương trình ion rút gọn, người ta loại bỏ những ion không tham gia phản ứng, còn những chất kết tủa, điện li yếu, chất khí được giữ nguyên dưới dạng phân tử.
II. Luyện tập
Bài 1 : Viết phương trình điện li của các chất sau: K2S, Na2HPO4, NaH2PO4, Pb(OH)2, HBrO, HF, HClO4.
Lời giải:
K2S → 2K++ S2-
Na2HPO4→ 2Na++ HPO42-
HPO42- ⇆ H+ + PO43-
NaH2PO4→ Na++ H2PO4-
H2PO4- ⇆ H+ + HPO42-
HPO42- ⇆ H+ + PO43-
Pb(OH)2⇆ Pb2++ 2OH-
Hoặc H2PbO2 ⇆ 2H+ + PbO22-
HBrO ⇆ H++ BrO-
HF ⇆ H++ F-
HClO4⇆ H++ ClO4-
Bài 2: Viết phương trình phân tử và ion rút gọn của các phản ứng (nếu có) xảy ra trong dung dịch các cặp chất sau:
- Na2CO3+ Ca(NO3)2
- FeSO4+ NaOH (loãng)
- NaHCO3+ HCl
- NaHCO3+ NaOH
- K2CO3+ NaCl
- Pb(OH)2(r) + HNO3
- Pb(OH)2(r) + NaOH
- CuSO4+ Na2S
Đáp án
Na2CO3+ Ca(NO3)2 → 2NaNO3+ CaCO3
Ca2+ + CO32- → CaCO3↓
FeSO4+ 2NaOH (loãng) → Fe(OH)2↓ + Na2SO4
Fe2+ + 2OH- → Fe(OH)2↓
NaHCO3+ HCl → NaCl + H2O + CO2↑
H+ + HCO3- → H2O + CO2↑
NaHCO3+ NaOH → Na2CO3 + H2O
HCO3- + OH- → CO32- + H2O
K2CO3+ NaCl Không có phản ứng
Pb(OH)2(r) + 2HNO3 → Pb(NO3)2+ 2H2O
Pb(OH)2 (r) + 2H+ Pb2+ + 2H2O
Pb(OH)2(r) + 2NaOH → Na2PbO2+ 2H2O
Pb(OH)2 (r) + 2OH- → PbO22- + 2H2O
CuSO4+ Na2S → CuS + Na2SO4
Cu2+ + S2- → CuS
Bài 3 : Viết phương trình hoá học (dưới dạng phân tử và ion rút gọn) của phản ứng trao đổi ion trong dung dịch tạo thành từng chất kết tủa sau: Cr(OH)3; Al(OH)3; Ni(OH)2
Lời giải:
CrCl3 + 3NaOH (đủ) → Cr(OH)3 ↓ + 3 NaCl
Cr3+ + 3OH- → Cr(OH)3 ↓
AlCl3 + 3NaOH (đủ) Al(OH)3 ↓ + 3 NaCl
Al3+ + 3OH- → Al(OH)3 ↓
Hoặc AlCl3 + 3NH3 (dư) + 3H2O → Al(OH)3 ↓ + 3NH4Cl
Al3+ + 3NH3 (dư) + 3H2O → Al(OH)3 ↓ + 3NH4+
Ni(NO3)2 + 2NaOH → Ni(OH)2 ↓ + 2NaNO3
Ni2+ + 2OH- → Ni(OH)2 ↓
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu pH của dung dịch HCL 10 mũ trừ 2 M. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11









