Tính chất, công thức hóa học của axit photphoric
Tính chất, công thức hóa học của axit photphoric được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Tính chất, công thức hóa học của axit photphoric
1. Axit photphoric là gì?
- Axit photphoric là một hợp chất cô lập liên kết với nhiều cation hóa trị II như Fe2+, Cu2+, Ca2+ và Mg2+. Đây là một axit 3 nấc không có tính oxi hóa vì nó có cấu trúc không gian tứ diện và có độ mạnh trung bình.
- Trên thị trường hiện nay, loại axit photphoric được cung ứng thường tồn tại ở dạng siro không màu, không mùi, không dễ bay hơi và có nồng độ là 85% trong nước. Các hợp chất tinh khiết thì tồn tại ở dạng rắn không màu và mặc dù không phải là một axit mạnh nhưng khi ở nồng độ 85% thì nó vẫn có thể gây kích ứng nghiêm trọng cho da, thậm chí là làm hỏng mắt.
* Công thức hóa học của Axit photphoric là: H3PO4
2. Cấu tạo phân tử của Axit photphoric
- Công thức cấu tạo:
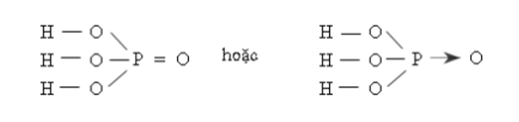
- Nhận xét: P có số oxi hóa + 5 và có hóa trị V.
3. Tính chất vật lý của Axit photphoric
- Acid phosphoric là chất rắn tinh thể không màu, khối lượng riêng 1,87 g/cm3; nhiệt độ nóng chảy = 42,35oC (dạng H3PO4.H2O có nhiệt độ nóng chảy = 29,32oC); phân hủy ở 213oC. Tan trong etanol, nước (với bất kì tỉ lệ nào). Trong cấu trúc tinh thể của nó gồm có những nhóm tứ diện PO43-, liên kết với nhau bằng liên kết hydro. Cấu trúc đó vẫn còn được giữ lại trong dung dịch đậm đặc của acid ở trong nước và làm cho dung dịch đó sánh giống như nước đường.
- Acid orthophosphoric tan trong nước đó được giải thích bằng sự tạo thành liên kết hydro giữa những phân tử H3PO4 và những phân tử H2O
4. Tính chất hóa học của Axit photphoric
Axit photphoric có độ axit mạnh trung bình và có các tính chất như sau:
- Phân ly thuận nghịch theo 3 nấc khi ở trong dung dịch với các hằng số axit ở 25 độ C tương ứng như sau:
H3PO4 ↔ H+ + H2PO4- ; K1 = 7.10 − 3
H2PO4- ↔ H+ + (PO4)2- ; K2 = 8.10 − 6
(HPO4)2- ↔ H+ + (PO4)3- ; K3 = 4.10 −13
Cả ba hydrogens trên đều có tính axit nhưng độ mạnh yếu khác nhau và có thể bị mất khỏi phân tử dưới dạng proton là ion H+. Khi mất cả ba ion H+ một ion orthophosphate là (PO4)3- sẽ được tạo ra và nó thường được gọi là "photphat". Axit orthophosphoric cũng tạo thành este là organophosphates. Tên gọi "axit orthophosphoric" có thể được dùng để phân biệt với " axit photphoric " khác, ví dụ như axit pyrophosphoric .
- Làm chuyển màu quỳ tím thành màu đỏ
- Phản ứng với oxit bazo tạo thành muối và nước
2H3PO4 + 3Na2O → 2Na3PO4 + 3H2O
- Phản ứng với bazo tạo thành muối và nước
Tùy theo tỉ lệ phản ứng giữa H3PO4 và bazo mà loại muối tạo thành cũng khác nhau:
H3PO4 + KOH → KH2PO4 + H2O
H3PO4 + 2KOH → K2HPO4 + 2H2O
H3PO4 + 3KOH → K3PO4 + 3H2O
- Phản ứng với kim loại đứng trước H để tạo ra muối và khí H2
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
- Phản ứng với muối để tạo thành muối mới và axit mới
H3PO4 + 3AgNO3 → 3HNO3 + Ag3PO4
- Tính oxi hóa – khử
Trong phân tử H3PO4, photpho có mức oxi hóa cao nhất nhưng nó lại không có tính oxi hóa như axit nitric vì nguyên tử P có bán kính lớn hơn so với bán kính của N và điều này đã khiến cho mật độ điện dương trên P nhỏ lại, kéo theo khả năng nhận electron kém đi.
- Xảy ra phản ứng nhiệt phân dưới tác dụng của nhiệt độ
Nhiệt độ từ 200 – 250 độ C, axit photphoric bị nhiệt phân theo phương trình:
2H3PO4 → H4P2O7 + H2O
Nhiệt độ từ 400 – 500 độ C, axit photphoric bị nhiệt phân theo phương trình
H4P2O7 → 2HPO3 + H2O
5. Quy trình sản xuất axit photphoric
- Hiện nay trên thế giới Axit photphoric thường được sản xuất theo hai quy trình chủ yếu sản xuất ra Axit Photphoric là quy trình ướt và gia nhiệt.
- Quy trình ướt: Axit Photphoric được sản xuất từ fluorapatite hay còn gọi là đá phốt phát Ca3(PO4)2 bằng cách thêm H2SO4 đậm đặc (93%) vào trong một loạt các lò phản ứng được khuấy trộn. Quá trình này diễn ra thu được H3PO4 và canxi sunfat CaSO4 cộng với các tạp chất không hòa tan khác.
Ca5(PO4)3X + 5H2SO4 → 5CaSO4 + 3H3PO4 + HX
3H2SO4 + Ca3(PO4)2 → 3CaSO4 + 2H3PO4
- Axit thu được từ quá trình ướt không tinh khiết nhưng có thể sử được mà không cần tinh chế thêm, sản phẩm này dùng để sản xuất phân bón.
- Quy trình gia nhiệt: Phương pháp nhiệt thường tạo ra một sản phẩm đậm đặc và tinh khiết hơn, nhưng lại tốn nhiều năng lượng. Nguyên liệu để sản xuất axit trong quy trình này là Photpho và không khí. Ban đầu photpho được phun vào lò và bị đốt cháy trong không khí vào khoảng 1527-2726oC thu được diphotpho pentaoxit.
P4 + 5O2 → 2P2O5
P2O5 + 3H2O → 2H3PO4
Sau đó hòa thêm nước ta thu được Axit Photphoric, sản phẩm của quá trình này rất tinh khiết do hầu hết các tập chất đã được loại bỏ khi đốt phosphor trong lò điện.
6. Ứng dụng Axit photphoric
- Thứ nhất, trong nông nghiệp H3PO4 được dùng để sản xuất phân lân như superphosphat đơn và phân supephosphat kép. Để bón cho cây cối và được sử dụng làm bán thành phẩm trong thức ăn gia súc.
- Thứ hai, trong dược phẩm, H3PO4 (Axit photphoric) được sử dụng trong nha khoa và chỉnh hình răng như một dung dịch khắc, để làm sạch và làm nhám bề mặt răng nơi các thiết bị nha khoa hoặc vật liệu trám răng sẽ được đặt. Ngoài ra, axit photphoric là thành phần cấu tạo trong xương và răng, có vai trò trong nhiều quá trình trao đổi chất.
- Thứ ba, trong mỹ phẩm, Axit Phophoric là thành phần có trong các sản phẩm làm sạch, tạo ra nước hoa, thuốc nhuộm, một số sản phẩm làm móng, trang điểm và những sản phẩm chăm sóc da. Nó được biết đến là chất kiểm soát nồng độ pH.
- Thứ tư, làm chất xúc tác trong tổng hợp hữu cơ, làm chất tẩm gỗ chống cháy để tạo nên những sản phẩm cửa, bàn ghế chống cháy, ứng dụng hàng ngày trong đời sống.
- Thứ năm, với những kim loại để lâu ở bên ngoài mô hình sẽ bị oxi hóa nên tạo lớp sơn cứng màu nâu dễ vỡ vì vậy H3PO4 làm chất chống ăn mòn kim loại, chống sét. Ngoài ra trong công việc không thể thiếu các loại thuốc trừ sâu để khắc phục cũng như phòng tránh những tác hại làm sâu bệnh sử dụng lên lò chậm phát triển, vì vậy ứng dụng của H3PO4 là một chất để sản xuất thuốc trừ sâu.
- Thứ sáu, trong thực phẩm đồ uống: H3PO3 là chất phụ gia trong quy trình sản xuất các loại nước giải khát, mứt, thạch rau câu để tạo hương thơm cho thực phẩm và kiểm tra sự hình thành nấm và vi khuẩn. Cụ thể: H3PO4 có trong coca, để cải thiện mùi vị và tạo vị chua. Axit này kết hợp với Hfcs (đã xử lý Enzymem), mục đích để tạo thêm vị ngọt.
=> H3PO4 có ứng dụng rộng rãi và quan trọng trong rất nhiều ngành trong đời sống của con người đây cũng chính là lý do mà H3PO4 lại trở thành 1 trong 7 axit quan trọng phổ biến nhất. Đọc ngay bài viết ứng dụng của axit photphoric và những lưu ý khi sử dụng.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Tính chất, công thức hóa học của axit photphoric. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11










