Hoàn thành PTHH sau: FeS + HCl?
Chúng tôi xin giới thiệu bài Hoàn thành PTHH sau: FeS + HCl? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Hoàn thành PTHH sau: FeS + HCl?
Câu hỏi: Hoàn thành PTHH sau: FeS + HCl?
Lời giải:
Phương trình hóa học như sau:
|
FeS |
+ |
2HCl |
→ |
FeCl2 |
+ |
H2S |
|
sắt (II) sulfua |
|
axit clohidric |
|
sắt (II) clorua |
|
hidro sulfua |
|
88 |
|
36,5 |
|
127 |
|
34 |
|
(rắn) |
|
(dd) |
|
(dung dịch) |
|
(khí) |
|
(đen) |
|
(không màu) |
|
(lục nhạt) |
|
(không màu) |
- Điều kiện phản ứng: nhiệt độ phòng
- Hiện tượng nhận biết: dung dịch chuyển màu lục nhạt (FeCl2) đồng thời có khí sủi bọt bay lên (H2S)
I. Định nghĩa hợp chất FeS
- Định nghĩa: Sắt(II) sunfua là một trong những khoáng chất tạo bởi hai nguyên tố Fe và lưu huỳnh với công thức hóa học là FeS.
- Công thức phân tử: FeS.
- Công thức cấu tạo: Fe=S
II. Tính chất vật lí
– Là chất rắn, màu đen, không tan trong nước nhưng tan trong dung dịch axit.
– Không gây độc do không tan trong nước.
III. Tính chất hóa học
- Có tính chất hóa học của muối.
- Tác dụng với axit:
FeS + 2HCl → FeCl2 + H2S
IV. Điều chế
Sắt(II) sulfide có thể được điều chế bằng cách cho hai nguyên tố thành phần là Fe và S phản ứng với nhau bằng cách đun nóng chúng.
Fe + S → FeS
V. Bài tập ví dụ
Ví dụ 1. Có hai muối là natri hiđrosunfit và sắt sunfua. Cho hai muối này tác dụng với axit HCl dư, thu được hai chất khí. Cho hai chất khí vừa thu được tác dụng với nhau, tạo thành 9,6 gam chất rắn. Tính khối lượng của NaHSO3 và FeS đã lấy để phản ứng. Biết hai khí tác dụng với nhau vừa đủ
Giải
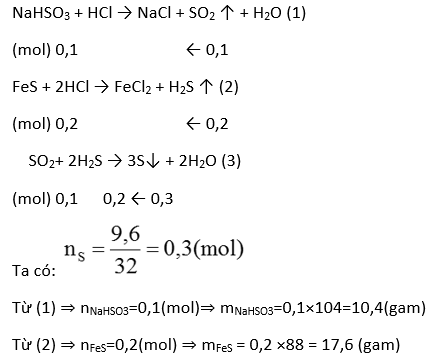
Ví dụ 2. Cho 20,8 gam hỗn hợp Fe, FeS, FeS2, S pư với H2SO4 đặc nóng dư thu được V lít SO2 ở đktc và dung dịch A. Cho A + NaOH dư thu được 21,4 gam kết tủa. Tính thể tích dung dịch thuốc tím 1M cần dùng để pư vừa đủ với V lít trên?
Hướng dẫn:
+ Quy đổi hỗn hợp ban đầu thành hỗn hợp Fe và S ta có:
+ Theo ĐLBT e và giả thiết ta có hệ: x = 0,2 mol và y = 0,3.
+ Áp dụng ĐLBT electron ta có: 2z = 3x + 6y
z = 1,2 mol
số mol KMnO4 = 1,2.2/5 = 0,48 mol
Vdd KmnO4 = 0,48 lít.
Ví dụ 3: Đun nóng 20 gam một hỗn hợp X gồm Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Hòa tan hỗn hợp rắn A vào dung dịch HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Thành phần phần trăm khối lượng Fe trong X là:
- 28%
- 56%
- 42%
- 84%
Đáp án đúng: D. 84%
Ví dụ 4. Hòa tan hết hỗn hợp X gồm Fe, FeS, Fe3O4 trong dung dịch H2SO4 đặc, nóng (dư) thu được dung dịch Y có khối lượng giảm 48 gam và 38,08 lít SO2 (đktc). Cho Y tác dụng với dung dịch NaOH (dư), lấy kết tủa rồi nung trong không khí đến khối lượng không đổi còn 64 gam chất rắn Z. Tính phần trăm theo khối lượng của Fe trong X?
- 68%
- 73,68%
- 43,18%
- 54%
Đáp án đúng: B. 73,68%
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Hoàn thành PTHH sau: FeS + HCl? Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11










