Hấp thụ SO3 bằng H2SO4 đặc 98 thu được oleum có công thức dạng
Dạng bài tập SO3 - Oleum
Hấp thụ SO3 bằng H2SO4 đặc 98 thu được Oleum có công thức dạng được VnDoc biên soạn hướng dẫn bạn đọc trả lời các câu hỏi liên quan đến xác định công thức hóa học của Oleum. Cũng như đưa ra các nội dung lý thuyết, câu hỏi bài tập liên quan.
Khi hấp thụ SO3 vào dung dịch H2SO4 đặc, người ta thu đc 1 loại oleum có công thức H2SO4.nSO3. Biết rằng , trong loại oleum trên chứa 36,7% về khối lượng là nguyên tố lưu huỳnh. Công thức của loại oleum trên là?
Hướng dẫn giải chi tiết bài tập
Gọi công thức hóa học của oleum là H2SO4.nSO3
Trong Oleum có 1+n nguyên tử S
Vậy :
![]() \(\%S = \frac{(1 + n).32}{98 + 80n} .100\%=36,7\%\)
\(\%S = \frac{(1 + n).32}{98 + 80n} .100\%=36,7\%\)
⇒ n = 1,5
Vậy công thức hóa học của oleum là H2SO4.1,5SO3
I. Oleum là gì?
Oleum là tên gọi của Sulfuric acid được biểu thị theo công thức H2SO4.nSO3 với n được định nghĩa là hàm lượng mol sulfur trioxide tự do.
SO3 + H2O → H2SO4
Hết H2O: nSO3 + H2SO4 → H2SO4.nSO3
Ví dụ: 3SO3 + H2SO4 → H2SO4.3SO3
Tên gọi khác: Sulfuric acid bốc khói.
Công thức của oleum: H2SO4.nSO3 nên khi tác dụng H2O ta có:
H2SO4.nSO3 + nH2O → (n +1) H2SO4
![]() \(\Rightarrow n_{Oleum}=\frac{n_{H_2SO_4}}{n+1}\)
\(\Rightarrow n_{Oleum}=\frac{n_{H_2SO_4}}{n+1}\)
Ví dụ:
H2SO4.3SO3 + 3H2O → 4H2SO4
Chú ý:
Coi H2SO4 ngậm H2SO4.nSO3 (oleum) là một dung dịch H2SO4 (áp dụng bài tập tính toán (bài tập pha chế dung dịch)
Khi pha trộn dung dịch thì có thể coi oleum là acid có nồng độ:
 \(C\%_{H_{2} SO_{4} } =\frac{m_{chất \: tan} }{m_{dung\: dịch}} .100\%=\frac{m_{H_{2} SO_{4}}}{m_{oleum}} .100\%\)
\(C\%_{H_{2} SO_{4} } =\frac{m_{chất \: tan} }{m_{dung\: dịch}} .100\%=\frac{m_{H_{2} SO_{4}}}{m_{oleum}} .100\%\)
![]() \(=\frac{(n+1).98}{98+80n} .100\%\)
\(=\frac{(n+1).98}{98+80n} .100\%\)
II. Câu hỏi vận dụng liên quan
Câu 1. Hãy xác định công thức của oleum A, biết rằng khi hoà tan 3,38 gam A vào nước người ta phải dung 800 ml dung dịch KOH 0,1M để trung hòa dung dịch A
A. H2SO4.5SO3
B. H2SO4.6SO3
C. H2SO4.3SO3
D. H2SO4.4SO3
Hướng dẫn trả lời
Gọi công thức của A là H2SO4.nSO3
Bảo toàn nguyên tố S, ta có
nH2SO4 trong ddA =(1 + n) nH2SO4.nSO3
→ nH2SO4.nSO3 = nH2SO4trongddA/(n+1)
Trung hòa dung dịch A cần 0,08 mol KOH
2KOH + H2SO4 → K2SO4 + 2H2O
0,08 mol → 0,04 mol
→nH2SO4.nSO3 = nH2SO4trongddA/(n + 1)= 0,04/(n + 1)
Mặt khác, → nH2SO4.nSO3 = 3,38/(98 + 80n) mol
→ 3,3898 + 80n = 0,04n + 1
→ n = 3
Câu 2. Trộn 676 gam oleum với 360 gam dung dịch H2SO4 80% thu được một loại oleum chứa 15,44% khối lượng SO3. Xác định công thức oleum ban đầu
A. H2SO4.3SO3
B. H2SO4.5SO3
C. H2SO4.4SO3
D. H2SO4.7SO3
Hướng dẫn trả lời
Oleum ban đầu là H2SO4.nSO3 với số mol là:
676/(98 + 80n) mol =>nSO3 =676n/(98 + 80n) mol
Dung dịch H2SO4 ban đầu chứa:
mH2SO4 = 288 gam; mH2O = 72 gam => nH2O = 4 mol
SO3 + H2O → H2SO4
4mol ← 4mol → 4mol
=>nSO3 du = 676n/(98+ 80n) − 4
Lượng SO3 dư này sẽ tạo ra oleum 15,44% SO3 nên:
%mSO3= (80.[676n/(98 + 80n)−4])/(676 + 360) = 15,44%
=>n = 3
Vậy oleum ban đầu là H2SO4.3SO3
Câu 3. Có một oleum có công thức là H2SO4.3SO3. Khối lượng oleum này cần dùng để cho vào 100 mL dung dịch H2SO4 40% (d=1,31 g/ml) để tạo ra oleum có hàm lượng SO3 10% gần nhất với giá trị nào sau đây?
A. 274,55 gam.
B. 823,65 gam.
C. 449,1 gam.
D. 594,1 gam.
Hướng dẫn trả lời
Đặt số mol của oleum là x → Trong oleum có số mol H2SO4 và SO3 lần lượt là x và 3x
mddH2SO4 = 100.1,31 = 131(g)
 \(\left\{\begin{matrix} m_{H_{2}SO_{4} }=\frac{131.40}{100} =52,4 (gam) \\ m_{H_{2}O} =131-52,4=78,6 (gam)\Rightarrow n_{H_{2}O}=\frac{131}{30} mol \end{matrix}\right.\)
\(\left\{\begin{matrix} m_{H_{2}SO_{4} }=\frac{131.40}{100} =52,4 (gam) \\ m_{H_{2}O} =131-52,4=78,6 (gam)\Rightarrow n_{H_{2}O}=\frac{131}{30} mol \end{matrix}\right.\)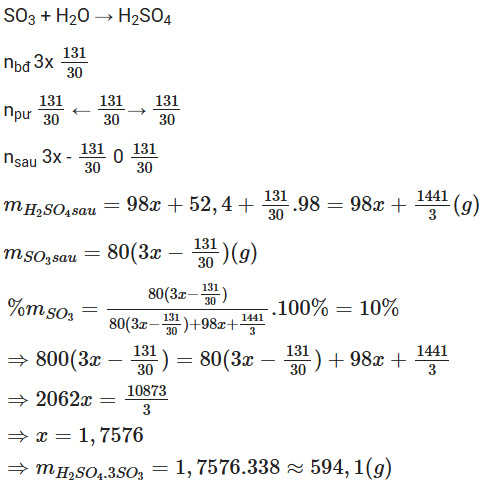
Câu 4. Cho 0,4 mol SO2 và 0,6 mol O2 vào một bình dung tích 1 lít được giữ ở một nhiệt độ không đổi. Phản ứng trong bình xảy ra như sau:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Khi phản ứng đạt đến trạng thái cân bằng, lượng SO3 trong bình là 0,3 mol. Tính hằng số cân bằng KC của phản ứng tổng hợp SO3 ở nhiệt độ trên.
Câu 5. Trong quy trình sản xuất sulfuric acid (H2SO4) có giai đoạn dùng dung dịch H2SO4 98% hấp thụ sulfur trioxide (SO3) thu được oleum (H2SO4 .nSO3). Sulfur trioxide được tạo thành bằng cách oxi hoá sulfur dioxide bằng oxygen hoặc lượng dư không khí ở nhiệt độ 450°C - 500°C, chất xúc tác vanadium(V) oxide (V2O5) theo phương trình hoá học:
![]() \(2SO_{2} (g) + O_{2}(g)\overset{V_{2}O_{5},450^{o} C-500^{o}C}{\rightleftharpoons} 2SO_{3}(g)\)
\(2SO_{2} (g) + O_{2}(g)\overset{V_{2}O_{5},450^{o} C-500^{o}C}{\rightleftharpoons} 2SO_{3}(g)\) ![]() \(\triangle _{r} H_{298}^{0} =-198,4kJ\)
\(\triangle _{r} H_{298}^{0} =-198,4kJ\)
a) Viết biểu thức tính hằng số cân bằng KC của phản ứng trên
b) Nồng độ ban đầu của SO2 và O2 tương ứng là 4M và 2M. Tính hằng số cân bằng của phản ứng, biết rằng khi đạt trạng thái cân bằng đã có 80% SO2 đã phản ứng.
c) Để có 90% SO2 đã phản ứng khi hệ đạt trạng thái cân bằng thì lúc đầu cần lấy lượng O2 là bao nhiêu?
III. Câu hỏi tự luyện tập
Câu 1. Cần bao nhiêu gam dung dịch H2SO4 35% để hòa tan vào đó 140 gam SO3 thì thu được dung dịch acid có nồng độ 70%.
Câu 2. Tính khối lượng SO3 và khối lượng dung dịch 20,5% cần lấy để pha chế được 340 gam dung dịch H2SO4 có nồng độ 49%.
Chi tiết câu hỏi bài tập nằm trong FILE TẢI VỀ
---------------------------------------------










