CO khử được các oxit kim loại nào?
CO khử được các oxit kim loại nào? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
CO khử được các oxit kim loại nào?
Câu hỏi: CO khử được các oxit kim loại nào? Viết phương trình hóa học minh họa.
Trả lời
- CO khử được các oxit của kim loại đứng sau nhôm (Al) trong dãy hoạt động hóa học.
- Phương trình tổng quát:
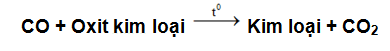
Ví dụ:
CO + CuO → CO2 + Cu (CO khử oxit đồng)
4CO + Fe3O4 → 3Fe + 4CO2 (CO khử oxit sắt trong lò cao)
1. Khí CO là khí gì?
Khí CO là chất khí có tên hóa học là Carbon monoxide không màu, không mùi và không vị. CO tan ít trong nước và rất bền với nhiệt độ. Phân tử của nó có liên kết 3 bền vững nên khi ở nhiệt độ thường thì rất trơ (chất khí này chủ yếu hoạt động ở nhiệt độ cao).
Khí CO là chất khử rất mạnh và là một oxit trung tính không có khả năng tạo muối.
Khí CO ( tên khoa học là Carbon Monoxide) là một hợp chất hóa học được sử dụng phổ biến trong nhiều lĩnh vực công nghiệp. Đóng vai trò quan trọng ngành chế biến thủy hải sản và bảo quản các loại thịt cá tươi xuất khẩu.
Chất CO tồn tại ở dạng khí không màu, không mùi và không vị, một số người vẫn nhầm lẫn rằng nó là khí có mùi. Vậy thực sự đặc điểm của khí CO ra sao, nó có độc hại không và làm sao để sử dụng khí CO an toàn, xử lý khi nhiễm độc khí CO?
2. Tính chất đặc điểm của khí CO là gì?
Khí cacbon monoxit hay Khí CO với công thức hóa học là CO, có các đặc điểm:
+ Khối lượng phân tử CO: 28,010 g/mol
+ Tỷ trọng của nó: 789 kg/m3
+ Thể lỏng: 1.250 kg /m3 ở 0°C, 1 atm, 1.145 kg /m3 ở 25°C, 1 atm
+ Độ nóng chảy của CO: -205,02°C (-337,04°F, 68,13 K)
+ Điểm sôi: -191,5°C (-312,7°F; 81,6 K)
Khí Carbon Monoxide là một oxit không màu, không mùi và trung tính, ít bị hòa tan trong nước, nhưng tan dễ dàng trong ethanol và trong benzen.
Khí CO rất độc, con người hít phải khí CO có thể gây tử vong.
3. Các nguồn phát sinh khí CO trong tự nhiên
- Từ các khí thải công nghiệp.
- Khu vực các núi lửa hoạt động.
- Xuất hiện ở các giếng khoan mỏ trầm tính.
- Hay trong quá trình con người sản xuất khí nhân tạo ethylence oxide.
4. Điều chế khí CO
+ Trong phòng thí nghiệm:
HCOOH → CO + H2O (H2SO4 đặc, to)
+ Trong công nghiệp:
C + H2O ↔ CO + H2 (1050 độ C)
CO2 + C → 2CO (to)
5. Phương pháp giải dạng bài tập có liên quan
- Phương chung để giải là dùng phương pháp bảo toàn electron hoặc bảo toàn nguyên tố hoặc bảo toàn khối lượng để giải.
- Chú ý:
+ Trong các phản ứng của C, CO, H2 thì số mol CO= nCO2, nC= nCO2, nH2= nH2O.
+ Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ.
+ Đa số khi giải chúng ta chỉ cần viết sơ đồ chung của phản ứng, chứ không cần viết PTHH cụ thể, tuy nhiên các phản ứng nhiệt nhôm nên viết rõ PTHH vì bài toán còn liên quan nhiều chất khác.
+ Thực chất khi cho CO, H2 tác dụng với các chất rắn là oxit thì khối lượng của chất rắn giảm đi chính là khối lượng của oxi trong các oxit.
6. Bài tập minh họa
Bài 1: Dẫn một luồng khí CO qua ống sứ đựng m gam hỗn hợp CuO, Fe2O3, Fe3O4 và Al2O3 rồi cho khí thoát ra hấp thụ hết vào dung dịch nước vôi trong dư thu được 15 gam kết tủa. Chất rắn còn lại trong ống sứ có khối lượng 215,0 gam. Giá trị của m là
A. 217,4g.
B. 219,8g.
C. 230,0g.
D. 249,0g.
Hướng dẫn giải:
+ Cách 1: Ta có xCO + M2Ox → 2M + xCO2
CO2 + Ca(OH)2 → CaCO3 + H2O
0,15 15/100 = 0,15 mol
→ nCO = nCO2 = 0,15 mol
m; m’ lần lượt là khối lượng chất rắn trước và sau phản ứng
Theo định luật bảo toàn khối lượng:
m + mCO = m' + mCO2 → m + 0,15.28 = 215 + 0,15.44 → m = 217,4g
→ Đáp án A
+ Cách 2:
Theo phương pháp tăng giảm khối lượng:
Cứ 1 mol CO phản ứng lấy mất 1 mol O trong oxit tạo ra 1 mol CO2 → khối lượng chất rắn giảm đi 16 gam
→ Vậy có 0,15 mol CO phản ứng → khối lượng chất rắn giảm đi 16.0,15 = 2,4 gam
→ Khối lượng chất rắn ban đầu là: m = 215 + 2,4 = 217,4 gam
→ Đáp án A
Bài 2: Dẫn một luồng khí CO dư qua ống sứ đựng Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 4,64 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 10 gam kết tủa. Tổng số gam 2 oxit ban đầu là:
Hướng dẫn giải:
Phương trình hóa học:
4CO + Fe3O4 → 3Fe + 4CO2
CO + CuO → Cu + CO2
Từ phương trình hóa học ta có:
nCO= nCO2 = x mol
Khí thoát ra khỏi bình dẫn qua dung dịch Ca(OH)2 thu được 10 gam kết tủa CaCO3
=> nCaCO3 = 10/100 = 0,1 mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,1 mol ← 0,1 mol
Bảo toàn khối lượng:
mCO + mhhFe3O4,CuO= mCO2 + mhhkl
=> 0,1.28 + m = 0,1.44 + 4,64 => m = 6,24 gam
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu CO khử được các oxit kim loại nào? Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11










