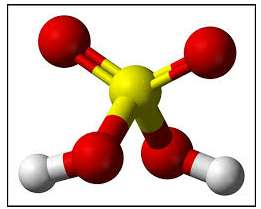
Công thức cấu tạo H2SO4
Chúng tôi xin giới thiệu bài Công thức cấu tạo H2SO4 được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Công thức cấu tạo H2SO4
Câu hỏi: Công thức cấu tạo H2SO4
Trả lời:
Công thức cấu tạo của H2SO4 là:
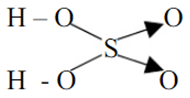
I. Cấu tạo phân tử axit sunfuric
- Công thức phân tử: H2SO4
- Công thức cấu tạo:

- Mô hình phân tử H2SO4
II. Tính chất vật lý của axit sunfuric H2SO4
- Axit sunfuric là chất lỏng, hơi nhớt và nặng hơn nước, khó bay hơi và tan vô hạn trong nước.
- Axit sunfuric đặc thường hút mạnh nước và tỏa nhiều nhiệt nên khi pha loãng phải cho từ từ axit đặc vào nước mà không làm ngược lại, vì H2SO4 có thể gây bỏng.
- Axit sunfuric còn có khả năng làm than hóa các hợp chất hữu cơ.
III. Tính chất hóa học
Đối với Axit sunfuric loãng
- H2SO4 là một axit mạnh, kể cả với nồng độ loãng thì hóa chất này cũng mang đầy đủ tính chất hóa học của một axit như:
- Axit Sunfuric làm chuyển màu quỳ tím thành đỏ
H2SO4 phản ứng với các kim loại đứng trước Hidro (trừ Pb) tạo muối sunfat
+ Phương trình hóa học minh họa:
2Al + 3H2SO4loãng → Al2(SO4)3 + 3H2↑
- H2SO4 phản ứng với oxit bazơ tạo muối mới (trong muối kim loại giữ nguyên giá trị) và nước. Phương trình hóa học minh họa:
AlO + H2SO4loãng → AlSO4 + H2O
- H2SO4 phản ứng với bazo tạo nước và muối mới. Phương trình hóa học minh họa:
NaOH + H2SO4loãng → NaHSO4 + H2O
2NaOH + H2SO4 → Na2SO4
- H2SO4 phản ứng với muối tạo muối mới và axit mới. Phương trình hóa học minh họa:
Na2CO3 +H2SO4loãng → Na2SO4 + H2O + CO2
Đối với Axit sunfuric đặc
H2SO4 đặc là hợp chất có axit và oxi hóa rất mạnh. Được chứng minh qua các thí nghiệm sau:
Thí nghiệm tác dụng với kim loại: Cho Axit Sulfuric đặc tác dụng với mảnh kim loại Cu tạo dung dịch màu xanh và có khí bay ra, có mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Thí nghiệm tác dụng với phi kim: Cho H2SO4 đặc tác dụng với nguyên tố phi kim như Cacbon (C) và Lưu Huỳnh (S) tạo thành oxit phi kim và nước, giải phóng khí SO2
S + 2H2SO4 → 3SO2↑ + 2H2O
C + 2H2SO4 → CO2 + 2H2O + 2SO2↑
Axit Sulfuric tác dụng với các chất khử khác: Cho H2SO4 tác dụng với chất khử (FeO, FeSO4) tạo thành muối và nước, giải phóng khí SO2
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 4H2O
2FeSO4 + 2H2SO4 → Fe2(SO4)3 + SO2↑ + 2H2O
Thí nghiệm tính háo nước của Axit Sunfuric: Cho H2SO4 vào cốc đựng đường, sau phản ứng đường trong cốc chuyển màu đen và sôi trào
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
IV. Ứng dụng của axit sunfuric
Axit sulfuric là hóa chất được sử dụng phổ biến nhất trên thế giới và được sử dụng trong hầu hết các ngành công nghiệp như sản xuất phân bón, dược phẩm, chất tẩy màu, công nghiệp hóa dầu…
Sản xuất hóa chất
Là một hợp chất hóa học rất quan trọng, axit sunfuric được sử dụng trong quá trình sản xuất một số hóa chất nổi tiếng bao gồm axit hydrochloric, axit nitric, axit photphoric và nhiều hóa chất công nghiệp khác.
Lọc dầu
Quá trình tinh chế dầu thô đòi hỏi phải sử dụng một axit làm chất xúc tác và axit sunfuric thường được sử dụng cho mục đích này. Nó loại bỏ các hợp chất lưu huỳnh và hydrocacbon không bão hòa có trong dầu thô.
Luyện kim
‘Pickling’ là một thuật ngữ được sử dụng để mô tả việc xử lý kim loại để loại bỏ tạp chất, rỉ sét hoặc cặn trên bề mặt, chẳng hạn như trong sản xuất thép. Ngày nay, việc sử dụng axit sulfuric cho mục đích này đã giảm đi một chút vì ngành công nghiệp hiện nay sử dụng axit hydrochloric. Mặc dù axit hydrochloric đắt hơn axit sulfuric, nhưng nó tạo ra kết quả nhanh hơn và giảm thiểu việc mất kim loại cơ bản trong quá trình tẩy.
Sản xuất vải rayon
Vải Rayon được làm từ sợi cellulose có nguồn gốc từ gỗ. Chúng được hòa tan trong dung dịch Tetra Amine Copper (II) để tạo ra một chất lỏng màu xanh đậm sau đó được bơm vào axit sulfuric để tạo thành sợi Rayon.
Sản xuất ắc quy chì
Axit sunfuric được sử dụng ở dạng loãng để hoạt động như một chất điện phân để liên kết các phần pin với nhau. Axit sulfuric được sử dụng theo cách này thường được gọi là Pin axit. Nó được sử dụng trong ngành công nghiệp ô tô cho xe hơi và xe tải.
Sản xuất thuốc
Axit sulfuric được sử dụng trong quá trình sản xuất các loại thuốc hóa trị kìm hóa chống và ngăn bệnh ung thư.
Sản xuất phân bón, thuốc trừ sâu
Để sản xuất phân bón, ammonium sulfate và superphosphate cần sử dụng nhiều axit sulfuric.
Nhiều loại thuốc trừ sâu sử dụng axit sunfuric làm nguyên liệu thô như đồng sunfat và kẽm sunfat để làm thuốc diệt nấm cho cây, thallium sulfate làm thuốc diệt chuột, và sunfat sắt và đồng sunfat làm thuốc diệt cỏ.
Nó còn được sử dụng để cải thiện đất đá vôi có độ pH cao.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Công thức cấu tạo H2SO4. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11