Nêu đặc điểm của Ankin
Nêu đặc điểm của Ankin được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Đặc điểm của Ankin
Câu hỏi: Nêu đặc điểm của Ankin?
Trả lời:
- Ankin là hiđrocacbon không no, mạch hở trong phân tử có chứa 1 liên kết ba C≡C còn lại là các liên kết đơn.
- Công thức tổng quát của anken: CnH2n-2 (n ≥ 2).
I. Đồng đẳng, đồng phân, danh pháp
1. Đồng đẳng, cấu tạo
- Công thức chung: CnH2n-2 (n ≥ 2).
- Công thức đơn giản nhất là axetilen (CH≡CH).
- Trong phân tử có 1 liên kết ba: gồm 1 liên kết σ và 2 liên kết π. Nguyên tử cacbon ở liên kết ba tham gia 2 liên kết σ nhờ 2 obitan lai hóa sp, còn 2 liên kết π nhờ 2 obitan p không lai hóa.
- Đặc biệt phân tử CH≡CH có cấu trúc đường thẳng.
- Trong phân tử C2H2 có 2 liên kết π làm độ dài liên kết C≡C giảm so với liên kết C=C và C-C. Các nguyên tử cacbon không thể quay tự do quanh liên kết 3.
2. Danh pháp, đồng phân
Danh pháp
- Tên gọi gồm: tên mạch cacbon có đuôi in
C2H2: Etin
C3H4: Propin
C4H6: Buten
C5H8: Pentin
C6H10: Hexin
C7H16: Hepten
C8H14: Octin
C9H16: Nonin
C10H22: Đecen
- Mạch chính là mạch cacbon có nối ba với số thứ tự của cacbon ở nối ba nhỏ nhất.
Đồng phân
- Hiện tượng đồng phân do: Mạch cacbon khác nhau, vị trí nối ba khác nhau. Ngoài ra còn có đồng phân dạng: ankadien và hiđrocacbon vòng.
- Từ C4 trở đi mới có đồng phân.
Ví dụ: C5H8 có 3 đồng phân.
CH≡C–CH2–CH2–CH3; CH3–C≡C–CH2–CH3
CH≡C–CH(CH3)–CH3
II. Tính chất vật lý
- Nhiệt độ nóng chảy nhiệt độ sôi tăng dần khi tăng số nguyên tử cacbon trong phân tử: 3 chất đầu là khí, các chất có n từ 5 → 16 là chất lỏng, khi n ≥ 17 là chất rắn.
- Đều ít tan trong nước, tan được trong một số dung môi hữu cơ (rượu, ete, …).
III. Tính chất hóa học
Cần lưu ý chất xúc tác trong mỗi phản ứng vì mỗi điều kiện có thể cho 1 chất sản phẩm khác nhau.
Phản ứng cộng
- Phản ứng cộng hiđrô
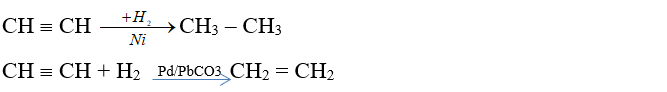
- Phản ứng cộng brom, clo
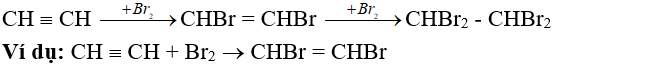
- Phản ứng cộng HX (X là OH; Cl; Br; CH3COO, ...)
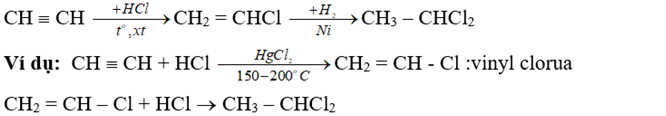
+ Phản ứng cộng của ankin với HX cũng tuân theo quy tắc Maccopnhicop.
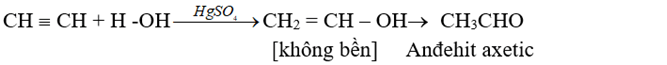
- Phản ứng đime hoá, trime hoá
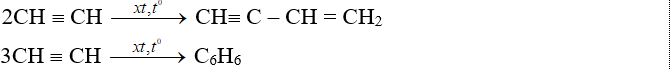
Phản ứng thế bằng ion kim loại
* Phản ứng của ank-1-in
CH≡CH + AgNO3 + NH3 → CAg≡CAg↓ (Bạc Axetilen) + 2NH4NO3
Nhận xét: Phản ứng này dùng để phân biệt ank-1-in với anken và ankan.
Phản ứng oxi hoá
- Phản ứng oxi hóa hoàn toàn
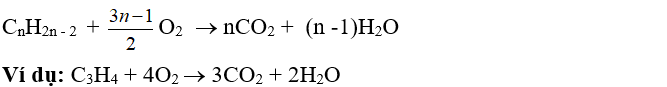
- Phản ứng oxi hóa không hoàn toàn: tương tự anken và ankađien, ankin cũng có khả năng làm mất màu dung dịch KMnO4.
IV. Điều chế
- Phương pháp chính điều chế axetilen trong công nghiệp hiện nay là nhiệt phân metan ở 1500 độ C, phản ứng thu nhiệt mạnh:
- Nhiệt độ sôi của axetilen là -75 độ C nên dễ được tách ra khỏi hỗn hợp với hiđro.
- Ở những nơi dầu khí chưa phát triển, người ta điều chế axetilen theo sơ đồ sau:
- Canxi cacbua sản xuất trong công nghiệp (từ vôi sống và than đá) là chất rắn màu đen xám, trước kia được dùng tạo ra C2H2 để thắp sáng vì vậy nó được gọi là “đất đèn”. Ngày nay, để điều chế một lượng nhỏ axetilen trong phòng thí nghiệm hoặc trong hàn xì, người ta vẫn thường dùng đất đèn. Axetilen điều chế từ đất đèn thường có tạp chất (H2S, NH3, PH3,... ) có mùi khó chịu được gọi là mùi đất đèn.
VI. Ứng dụng
- Khi axetilen cháy trong oxi, nhiệt độ ngọn lửa có thể lên tới 3000 độ C. Vì vậy, axetilen được dùng làm nhiên liệu trong đèn xì oxi – axetilen để hàn cắt kim loại.
- Trong công nghiệp, axetilen là nguyên liệu để sản xuất poli (vinyl clorua) (dùng để sản xuất nhựa PVC), cao su, axit axetic và nhiều hóa chất khác như vinyl clorua, vinyl axetat, vinylaxetilen, anđehit axetic,...
- Lưu ý, khi sử dụng axetilen phải rất cẩn trọng vì khi nồng độ axetilen trong không khí từ 2,5% trở nên có thể gây cháy nổ.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Nêu đặc điểm của Ankin. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11









