Dung dịch Amoniac trong nước có chứa những ion nào?
Dung dịch Amoniac trong nước có chứa những ion nào? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Dung dịch Amoniac trong nước có chứa những ion nào?
Trắc nghiệm: Dung dịch Amoniac trong nước có chứa những ion nào?
- NH4+, NH3.
- NH4+, NH3, H+.
- NH4+, NH3, OH-.
- NH4+, OH-.
Trả lời:
Đáp án: D. Dung dịch amoniac có chứa ion NH4+, OH-.
I. Khái niệm về Amoniac
Amoniac là một hợp chất vô cơ có công thức phân tử NH3. Ở điều kiện tiêu chuẩn, nó là một chất khí độc, có mùi khai, tan nhiều trong nước. Ở dạng dung dịch NH4OH hay dung dịch Amoniac là một dung dịch bazơ yếu, phân hủy thành khí NH3 và nước.
II. Tính chất vật lý
-Amoniac thường tồn tại ở dạng khí, không màu, có mùi hôi khó chịu. Nồng độ Amoniac lớn có thể gây chết người.
-Amoniac có độ phân cực lớn do phân tử NH3 có cặp electron tự do và liên kết N–H bị phân cực. Do đó NH3 là chất dễ hoá lỏng.
-Dung dịch Amoniac là dung môi hoà tan tốt: NH3 hoà tan các dung môi hữu cơ dễ hơn nước do có hằng số điện môi nhỏ hơn nước. Kim loại kiềm và các kim loại Ca, Sr, Ba có thể hòa tan trong NH3 lỏng tạo dung dịch xanh thẫm.
III. Tính chất hóa học của dung dịch Amoniac
1. Amoniac có tính bazơ yếu
- Amoniac do tính bazơ nên dung dịch Amoniac làm cho quỳ tím hóa xanh còn dung dịch phenolphlatein từ màu chuyển thành hồng.
- Do đó để phát hiện amoniac, người ta dùng quỳ tím ẩm để nhận biết.
- Nguyên nhân: do cặp e chưa tham gia liên kết ở nguyên tử N
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
a) Amoniac phản ứng với nước
NH3 + H2O ⇔ NH4+ + OH-
b) Amoniac phản ứng với Axit → Muối Amoni
Ví dụ:
NH3 (khí) + HCl (khí) → NH4Cl (khói trắng)
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
c) Amoniac tác dụng với dung dịch muối của các kim loại mà hidroxit không tan → bazơ và muối
NH3 + Muối (dung dịch) → Bazơ + Muối mới
Ví dụ
2NH3+ MgCl2 + 2H2O → Mg(OH)2 + 2NH4Cl
3NH3 + AlCl3+ 3H2O →Al(OH)3↓ + 3NH4Cl
- Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan
Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2 .
Ví dụ:
ZnSO4+ 2NH3+ 2H2O → Zn(OH)2↓ + (NH4)2SO4
Zn(OH)2 + 4NH3 → [Zn(NH3)3](OH)2
2. Amoniac có tính khử mạnh
- Nguyên nhân: do N trong NH3 có mức oxi hóa thấp nhất -3
a) Amoniac tác dụng với O2
4NH3 + 3O2 → 2N2↑ + 6H2O
4NH3 + 5O2 → 4NO↑ + 6H2O
b) Amoniac tác dụng với Cl2
2NH3 + 3Cl2 → N2↑ + 6HCl
8NH3 + 3Cl2 → N2↑ + 6NH4Cl
c) Amoniac tác dụng với oxit của kim loại
Ví dụ:
3CuO + 2NH3 → Cu + 3H2O + N2↑
3. Khả năng tạo phức
- Dung dịch Amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
VI. Điều chế
Trong phòng thí nghiệm
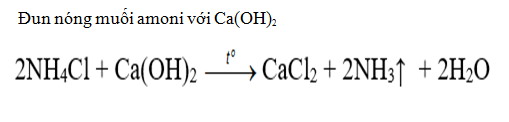
Trong công nghiệp
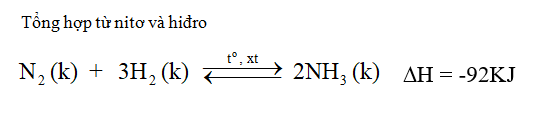
- Nhiệt độ: 450 – 500oC.
- Áp suất cao từ 200 – 300 atm.
- Chất xúc tác: sắt kim loại được trộn thêm Al2O3, K2O, ...
- Làm lạnh hỗn hợp khí bay ra, NH3 hóa lỏng được tách riêng.
V. Ứng dụng của dung dịch Amoniac trong công nghiệp
Phân bón
- Trên thực tế có đến khoảng 83% Amoniac lỏng được dùng làm phân bón vì trong tất cả các hợp chất Nito đều có nguồn gốc từ NH3, rất cần thiết cho sự phát triển của cây trồng.
- Năm 2004, của Amoniac được sử dụng như phân bón hoặc như là các muối của nó hoặc là giải pháp. Khi áp dụng cho đất, giúp cung cấp năng suất gia tăng của các loại cây trồng như ngô và lúa mì.
- Tiêu thụ nhiều hơn 1% của tất cả các năng lượng nhân tạo, sản xuất Amoniac là một thành phần quan trọng của ngân sách năng lượng thế giới.
Dùng làm thuốc tẩy
- Amoniac được dùng trong hộ gia đình là dung dịch NH3 trong nước được sử dụng làm chất tẩy rửa cho nhiều bề mặt. Amoniac lỏng tạo ra ánh sáng rực rỡ.
- Trong đó, Amoniac được dùng để làm sạch thủy tinh, đồ sứ và thép không gỉ, hay được sử dụng để làm sạch lò nướng và ngâm đồ để làm sạch bụi bặm…
Trong ngành dệt may
- Amoniac lỏng được sử dụng trong xử lý môi trường nhằm loại bỏ các chất như Nox, Sox trong các khí thải khí đốt các nguyên liệu hóa thạch như than, đá…
Làm chất chống khuẩn trong thực phẩm
- AmoniaC là một chất khử mạnh, Amoniac khan hiện được sử dụng với mục đích thương mại để giảm hoặc loại bỏ nhiễm khuẩn của thịt bò.
Trong công nghiệp chế biến gỗ
- Amoniac lỏng được sử dụng trong chế biến gỗ, làm cho màu sắc đậm hơn bởi khí Amoniac phản ứng với tự nhiên trong gỗ và làm thay đổi màu sắc đẹp hơn.
Sử dụng trong ngành công nghiệp dầu khí
- Sử dụng Amoniac trong trung hòa acid, thành phần của dầu thô và bảo vệ các thiết bị khỏi bị ăn mòn.
Trong ngành công nghiệp khai thác mỏ
- Amoniac được sử dụng để khai thác các kim loại như đồng niken và molypden từ quặng của họ.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Dung dịch Amoniac trong nước có chứa những ion nào? Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11









