Phản ứng nào chứng minh H2SiO3 yếu hơn H2CO3?
Chúng tôi xin giới thiệu bài Phản ứng nào chứng minh H2SiO3 yếu hơn H2CO3? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Phản ứng nào chứng minh H2SiO3 yếu hơn H2CO3?
Trắc nghiệm: Phản ứng nào chứng minh H2SiO3 yếu hơn H2CO3?
- Na2SiO3+ CO2+ H2O → Na2CO3 + H2SiO3
- Na2SiO3+ 2HCl → 2NaCl + H2SiO3
- H2SiO3+ 2 NaOH → Na2SiO3+ 2H2O
- SiO2 + 2 NaOH → Na2SiO3+ H2O
Trả lời:
Đáp án: A . Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3
Giải thích:
Phản ứng chứng tỏ axit silixic yếu hơn axit cacbonic là phản ứng giữa H2CO3 và muối của axit silixic: axit silixic bị axit axit cacbonic mạnh hơn đẩy ra khỏi muối.
=> Phản ứng chứng tỏ axit silixic yếu hơn axit cacbonic là
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3
I. Silic
1. Vị trí
Trong bảng tuần hoàn silic ở ô thứ 14, nhóm IVA, chu kì 3. Cấu hình electron: 1s22s22p63s23p2.
2. Tính chất vật lý
Có các dạng thù hình là silic tinh thể và silic vô định hình
- Silic tinh thể có cấu trúc giống kim cương, màu xám, có ánh kim và có tính bán dẫn
- Silic vô định hình là chất bột màu nâu
3. Tính chất hóa học
- Silic có các số oxi hóa: -4, 0, +2 và +4 (số oxi hóa +2 ít đặc trưng hơn).
- Trong các phản ứng hóa học, silic vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
Tính khử
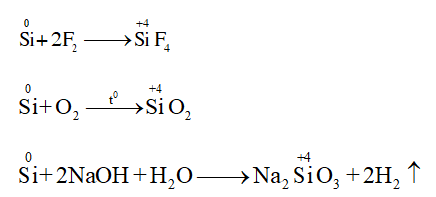
Tính oxi hóa
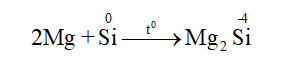
4. Trạng thái tự nhiên
- Trong tự nhiên silic chỉ tồn tại ở dạng hợp chất: chủ yếu là silic đioxit; các khoáng vật silicat và aluminosilicat như cao lanh, mica, fenspat, đá xà vân, thạch anh,...
5. Ứng dụng
- Silic siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện tử, để chế tạo tế bào quang điện, bộ khuếch đại, bộ chỉnh lưu, pin mặt trời, ...
- Trong luyện kim, silic được dùng để tách oxi khỏi kim loại nóng chảy. Ferosilic là hợp kim được dùng để chế tạo thép chịu axit.
6. Điều chế
- Điều chế silic bằng cách dùng chất khử mạnh như magie, nhôm, cacbon khử silic đioxit ở nhiệt độ cao.
II. Hợp chất của silic
1. Silic đioxit (SiO2)
- Là chất ở dạng tinh thể, nóng chảy ở 1713oC, không tan trong nước.
- Silic đioxit tan chậm trong dung dịch kiềm đặc, nóng, tan dễ trong kiềm nóng chảy.
- Silic đioxit tan được trong axit flohiđric nên người ta dùng dung dịch HF để khắc chữ và hình lên thủy tinh.
- Trong tự nhiên, silic đioxit tồn tại dưới dạng cát và thạch anh. Silic đioxit là nguyên liệu quan trọng để sản xuất thủy tinh, đồ gốm, ...
Tính chất vật lý
- Là chất ở dạng tinh thể nguyên từ và không tan khi tiếp xúc với nước.
- Trong tự nhiên tồn tại chủ yếu ở dạng khoáng vật được gọi là thạch anh.
Tính chất hóa học
- SiO2 có tính chất oxit axit, tan dễ dàng trong dung dịch kiềm nóng chảy hoặc cacbonat kim loại kiềm nóng chảy nhưng lại tan chậm khong dung dịch kiềm.
SiO2 + 2NaOH → Na2SiO3 + H2O
SiO2 + Na2CO3 → Na2SiO3 + CO2
- SiO2 dễ dàng tan trong axit HF ngay sau khi tiếp xúc, phản ứng này còn được dùng để khắc chữ trên thủy tinh.
SiO2 + 4HF → SiF4 + 2H2O
III. Axit silixic (H2SiO3)
1. Tính chất vật lý
- Là chất ở dạng keo, không tan trong nước, dễ mất nước khi đun nóng. Khi sấy khô, axit silixic mất một phần nước, tạo thành vật liệu xốp là silicage có khả năng hấp phụ mạnh được dùng để hút hơi ẩm trong các thùng đựng hàng hóa.
2. Tính chất hóa học
a) Phản ứng nhiệt phân:
H2SiO3 → SiO2 + H2O
b) Tác dụng được với axit cacbonic
Na2SiO3 + CO2 + H2O → Na2CO3+ H2SiO3
Điều chế:
- Điều chế H2SiO3 bằng cách dùng axit mạnh đẩy ra khỏi muối
Na2SiO3 + 2HCl → 2NaCl + H2SiO3
Na2SiO3 + CO2 + H2O → H2SiO3+ Na2CO3
- Thủy phân một số hợp chất của Si.
SiCl4 + 3H2O → H2SiO3+ 4HCl
Ứng dụng:
- Khi sấy khô, H2SiO3 mất một phần nước tạo thành vật liệu xốp là silicagen được dùng làm chất hút ẩm và hấp phụ nhiều chất.
III. Muối silicat
- Là muối của axit silicic thường không màu, khó tan (trừ muối kim loại kiềm tan được).
- Dung dịch đậm đặc của Na2SiO3 được gọi là thủy tinh lỏng được dùng để chế tạo keo dán thủy tinh và sứ, bảo quản vải và gỗ khỏi bị cháy. Trong dung dịch, silicat của kim loại kiềm bị thủy phân mạnh tạo môi trường bazơ:
Na2SiO3 + 2H2O → 2Na+ + 2OH + H2SiO3
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Phản ứng nào chứng minh H2SiO3 yếu hơn H2CO3? Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11









