Các công thức hóa học cần nhớ lớp 11
Các công thức hóa học cần nhớ lớp 11 được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Các công thức hóa học cần nhớ lớp 11
Tóm tắt công thức Hóa học lớp 11 Chương 1
1. Độ điện li (α)
α = n / n0
- Trong đó:
+ n là số phân tử phân li ra ion;
+ no là tổng số phân tử hòa tan.
2. Hằng số phân li axit (Ka)
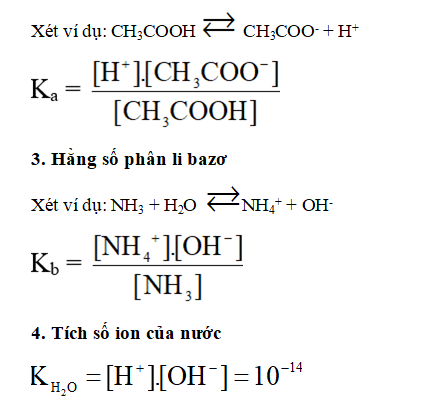
5. Hằng số phân li bazơ
Xét ví dụ: NH3 + H2O → NH4+ + OH-
Kb = ( [NH4+] . [OH-]) / [NH3]
6. Tích số ion của nước
KH2O = [H+]. [OH-] = 10-4
7. Tính pH
- Quy ước: [H+] = 1,0.10-pH M. Nếu [H+] = 10-aM thì pH = a.
- Công thức: pH = -log[H+]
- Hoặc pH = 14 + log[OH-].
Quan hệ giữa pH và môi trường
- pH = 7: Môi trường trung tính;
- pH < 7: Môi trường axit;
- pH > 7: Môi trường bazơ.
Tóm tắt công thức Hóa học lớp 11 Chương 2
1. Tính số mol HNO3 cần dùng để hòa tan hỗn hợp các kim loại:
nHNO3 = 4nNO + 2nNO2 + 10nN2O +12nN2 +10nNH4NO3
- Lưu ý:
+) Không tạo ra khí nào thì số mol khí đó bằng 0.
+) Giá trị nHNO3 không phụ thuộc vào số kim loại trong hỗn hợp.
+) Công thức này chỉ dùng khi cho hỗn hợp kim loại tác dụng với HNO3.
+) Chú ý khi tác dụng với Fe3+ vì Fe khử Fe3+ về Fe2+ nên số mol HNO3 đã dùng để hoà tan hỗn hợp kim loại nhỏ hơn so với tính theo công thức trên. Vì thế phải nói rõ HNO3 dư bao nhiêu %.
2. Tính khối lượng muối nitrat kim loại thu được khi cho hỗn hợp các kim loại tác dụng HNO3 (không có sự tạo thành NH4NO3):
mmuối = mKL + 62.(3nNO + nNO2 + 8nN2O +10nN2)
- Lưu ý:
+) Không tạo ra khí nào thì số mol khí đó bằng 0.
+) Nếu có sự tạo thành NH4NO3 thì cộng thêm vào mNH4NO3 có trong dd sau phản ứng.
3. Tính hiệu suất phản ứng tổng hợp NH3:
- Nếu tiến hành tổng hợp NH3 từ hỗn hợp gồm N2 và H2 với tỉ lệ mol tương ứng là 1:3 thì hiệu suất tổng hợp là:
H% = 2 – 2. (Mx / My)
- Với X là hỗn hợp ban đầu và Y là hỗn hợp sau.
4. Bài toán cho P2O5 hoặc H3PO4 vào dung dịch kiềm
- Đặt T =- H3PO4)
- Nếu:
T ≤ 1: Tạo muối H2PO4-
T = 2: Tạo muối HPO4-
T ≥ 3: Tạo muối PO43-
1 < T < 2: Tạo hai muối H2PO4- và HPO42-
2 < T < 3: Tạo hai muối HPO42- và PO43-
Tóm tắt công thức Hóa học lớp 11 Chương 3
- Bài toán dẫn khí CO2 vào dung dịch kiềm
Đặt T = nOH- / nCO2
+ T ≥ 2: chỉ tạo muối trung hòa;
+ T ≤ 1: chỉ tạo muối axit;
+ 1 < T < 2: thu được cả muối trung hòa và muối axit.
- Chú ý:
mbình tăng = mchất hấp thụ
- Nếu sau phản ứng có kết tủa:
mdd tăng = mchất hấp thụ - mkết tủa
mdd giảm = mkết tủa – mchất hấp thụ
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Các công thức hóa học cần nhớ lớp 11. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11










