Công thức cấu tạo của HNO3
Công thức cấu tạo của HNO3 được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Công thức cấu tạo của HNO3
Câu hỏi: Công thức cấu tạo của HNO3
Trả lời:
Công thức cấu tạo HNO3:
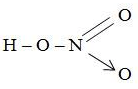
1. Định nghĩa Axit Nitric (HNO3)
Axit nitric là một hợp chất hữu cơ có tên gọi hóa học chung đó là HNO3. Ở dạng chất lỏng, HNO3 thường không có màu và có bốc khói mạnh trong không khí có độ ẩm. Ở tự nhiên Axit Nitric được cấu thành và tạo ra từ những đợt sấm chớp và mưa sét. Cho đến hiện đại theo các chứng minh khoa học thì HNO3 là một tác nhân gây ra các trận mưa Axit hủy diệt.
Chính vì sự đặc biệt này nên HNO3 luôn là một hợp chất hóa học có tính sát thương và nguy hiểm cao. Nó là một chất axit cực độc, dễ ăn mòn và dễ tạo ra cháy nổ có tính sát thương cũng cực kỳ cao. Ngoài thực tế HNO3 không màu, ở dạng tinh khiết, nếu như bạn để lâu thì HNO3 sẽ bị chuyển sang màu vàng.
Màu vàng ở đây là do sự tích tụ của các nito oxit. Về cơ bản, nếu như một dung dịch có khoảng hơn 86% axit nitric, nó sẽ được gọi với cái tên đó là Axit nitric bốc khói. Axit nitric bốc khói có các đặc trưng đó là có bốc khói màu trắng và có axit nitric bốc khói màu đỏ. 2 đặc trưng này sẽ bị phụ thuộc vào số lượng nito dioxit đang hiện diện.
2. Tính chất vật lý của axit nitric
- Công thức hóa học: HNO3
- Khối lượng phân tử chính: 63.012g. mol −1
- Ngoại quan: Chất lỏng bốc khói không màu, vàng hoặc đỏ
- Mùi: vị chát, ngột ngạt
- Tỉ trọng: 1,51 g cm3, 1,41 g cm3 [68% w / w]
- Độ nóng chảy: −42°C (−44°F; 231 K)
- Điểm sôi: 83°C (181°F; 356 K) dung dịch 68% sôi ở 121°C (250°F; 394 K)
- Độ hòa tan trong nước: Hoàn toàn có thể trộn được
- Đăng nhập P: .130,13
- Áp suất hơi: 48 mmHg (20°C)
- Độ Axit: −1.4
- Cơ sở liên hợp: Nitrat
- Nhạy cảm từ: 1,99 × 10−5 cm3/ mol
- Chỉ số khúc xạ: 1.394 (16,5°C)
- Khoảnh khắc lưỡng cực: 2,17 ± 0,02 D
3. Tính chất hóa học của HNO3
Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
– Axit nitric có tính chất của một axit bình thường nên nó làm giấy quỳ tím chuyển sang màu đỏ.
– Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
– Axit nitric tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O (to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
– Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
– Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
– Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
– Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
– Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
4. Công dụng phổ biến của Axit Nitric
Axit Nitric được sử dụng cho quá trình nitrat hóa để tạo ra các hợp chất nitro trong phòng thí nghiệm hoặc công nghiệp. Các hợp chất hóa học thu được có độ ổn định, vì vậy chúng có thể được sử dụng trong sản xuất nhiều loại sản phẩm.
Acid Nitric được sử dụng để sản xuất thuốc nổ bao gồm nitroglycerin, trinitrotoluan và các RDX cũng như phân bón.
Được sử dụng trong phòng thí nghiệm trường học để tiến hành các thí nghiệm liên quan đến việc thử clorit. Cho axit nitric tác dụng với mẫu thử, sau đó cho dung dịch bạc nitrat vào để tìm kết tủa trắng của bạc clorua.
Trong kỹ thuật ICP-MS và ICP-AES, Axit Nitric (với nồng độ từ 0,5% đến 2,0%) được sử dụng như một hợp chất nền để xác định dấu vết kim loại trong các dung dịch. Trong kỹ thuật này cần phải dùng axit này cực tinh khiết vì một số lượng ion kim loại nhỏ có thể gây ảnh hưởng đến kết quả phân tích.
Còn được sử dụng trong ngành luyện kim và tinh lọc vì nó phản ứng với phần lớn kim loại và trong các tổng hợp chất hữu cơ. Khi kết hợp với axit clohydric, nó tạo thành nước cường toan, một trong những chất phản ứng có thể hòa tan vàng và bạch kim (platinum).
Được dùng làm chất thử màu (colorometric test) để phân biệt heroin và morphine.
Ngoài ra Axit Nitric được sử dụng trong nhiên liệu tên lửa và kiểm tra độ thật giả của vàng.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Công thức cấu tạo của HNO3. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11










