Hoàn thành phương trình hóa học sau: C2H2 → C2H4
VnDoc xin giới thiệu bài Hoàn thành phương trình hóa học sau: C2H2 → C2H4 được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Câu hỏi: Hoàn thành phương trình hóa học sau:
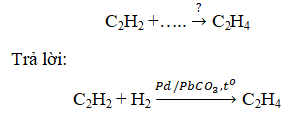
- C2H2, C2H4 là Hidrocacbon Không no
- Điều kiện phản ứng: Nhiệt độ, Pd/PbCO3 hoặc Pb/BaSO4
- Phản ứng Cộng Hidro
- Giải thích: C2H2 là Ankin, Ankin tham gia phản ứng cộng với một hay hai phân tử tác nhân tạo thành hợp chất không no loại Anken hợp chất no
- Khi có Niken (hoặc Platin hoặc palađi) làm xúc ta, ankin cộng hiđro tạo thành Anken, sau đó tạo thành Ankan. Nhưng khi chất xúc tác là Nhiệt độ, Pd/PbCO3 hoặc Pb/BaSO4, Ankin chỉ cộng một phân tử hidro tạo thành Anken
I. Ankin
1. Khái niệm, đồng phân, danh pháp của Ankin
- Ankin là hiđrocacbon không no, mạch hở trong phân tử có chứa 1 liên kết ba CΞC còn lại là các liên kết đơn.
- Công thức tổng quát của ankin: CnH2n-2 (n ≥ 2).
- Ankin đơn giản nhất - C2H2 (axetilen)
- Tên gọi:
+ Tên thay thế:
Số chỉ vị trí mạch nhánh + tên nhánh + tên mạch chính + số chỉ vị trí nối ba + in
+ Tên thường:
Tên gốc hiđrocacbon gắn với C mang liên kết ba + axetilen
- Ankin có các loại đồng phân: đồng phân bixicloankan (n ≥ 4), đồng phân vị trí liên kết ba (n ≥ 4); đồng phân mạch C (n ≥ 5); đồng phân xicloanken, đồng phân ankađien.
2. Tính chất hóa học
Phản ứng cộng
*Cộng H2
CnH2n-2 + H2 → CnH2n (Pd/PbCO3, to)
CnH2n-2 + 2H2 → CnH2n+2 (Ni, to)
Chú ý:
- Tuỳ thuộc vào xúc tác được sử dụng mà phản ứng cộng H2 vào ankin xảy ra theo các hướng khác nhau.
- Thường thì phản ứng cộng H2 vào ankin thường tạo ra hỗn hợp gồm nhiều sản phẩm.
- Số mol khí giảm = số mol H2 tham gia phản ứng. Chú ý bảo toàn khối lượng, bảo toàn H, bảo toàn C.
*Cộng Br2
CnH2n-2 + Br2 → CnH2n-2Br2
CnH2n-2 + 2Br2 → CnH2n-2Br4
Khối lượng dung dịch brom tăng chính là khối lượng ankin đã phản ứng.
*Cộng HX
- Cộng H2O:
+ C2H2 → anđehit
CHΞCH + H2O → CH3 - CHO (H2SO4, HgSO4, 800oC)
+ Ankin khác → xeton
CHΞC-CH3 + H2O → CH3-CO-CH3 (H+)
- Cộng axit:
CHΞCH + HCl → CH2=CHCl (vinyl clorua) (Hg2Cl2 ở 150 đến 200oC)
CHΞCH + HCN → CH2=CH-CN (nitrin acrylic)
CHΞCH + CH3COOH → CH3COOCH=CH2 (vinylaxetat)
CHΞCH + C2H5OH → CH2=CH-O-CH3 (etylvinylete)
Phản ứng trùng hợp
- Đime hóa
2CHΞCH → CHΞC-CH=CH2 (vinyl axetilen) (NH4Cl, Cu2Cl2, to)
- Trime hóa
3CHΞCH → C6H6 (C, 600oC)
- Trùng hợp (polime hóa)
nCHΞCH → (-CH=CH-)n (xt, to, p) (nhựa cupren)
Phản ứng oxi hóa
*Phản ứng oxi hóa hoàn toàn
CnH2n-2 + (3n - 1)/2O2 → nCO2 + (n - 1)H2O
→ Đặc điểm của phản ứng đốt cháy ankin: nCO2 > nH2O và nCO2 - nH2O = nankin.
*Phản ứng oxi hóa không hoàn toàn
- Các ankin đều làm mất màu dung dịch thuốc tím ở nhiệt độ thường.
3C2H2 + 8KMnO4 + 2H2O → 3(COOK)2 + 2MnO2 + 2KOH
Nếu trong môi trường axit thì tạo thành CO2 sau đó CO2 phản ứng với KOH tạo thành muối.
- Với các ankin khác sẽ có sự đứt mạch tạo thành hỗn hợp 2 muối.
R1-CΞC-R2 + 2KMnO4 → R1COOK + R2COOK + 2MnO2
Phản ứng thế của ank-1-in
CHΞCH + Ag2O → CAgΞCAg↓ + H2O
2CHΞC-R + Ag2O → CAgΞC-R↓ (vàng) + H2O
Chú ý:
- Chỉ có C2H2 mới phản ứng với Ag2O theo tỉ lệ mol 1:1; các ank-1-in khác chỉ phản ứng theo tỉ lệ 2:1.
- Nếu có hỗn hợp ankin tham gia phản ứng với Ag2O mà tỉ lệ mol của (ankin: Ag2O) = k có giá trị:
+ k < 2 → có C2H2.
+ k > 2 → không có C2H2
+ k = 2 → hỗn hợp gồm 2 ank-1-in hoặc hỗn hợp C2H2 và ankin khác (không phải ank-1-in) có số mol bằng nhau.
- Từ kết tủa vàng thu được có thể khôi phục lại ankin ban đầu bằng cách cho tác dụng với HCl.
CAgΞC-R + HCl → CHΞC-R + AgCl
(phản ứng này dùng để tách ank-1-in khỏi hỗn hợp)
- Ngoài cách viết với Ag2O có thể viết phản ứng với dung dịch AgNO3/NH3 và phản ứng này được dùng để nhận biết ank-1-in.
II. Anken
1. Đồng đẳng, đồng phân, danh pháp của Anken
Dãy đồng đẳng
- CTTQ chung của dãy đồng đẳng anken là: CnH2n (n ≥ 2)
Danh pháp
* Tên thông thường: Tên ankan – an + ilen
Ví dụ: CH2=CH2 etilen;
CH2=CH–CH3 Propilen
* Tên thay thế: gọi tên theo cách sau:
- Chọn mạch chính là mạch C dài nhất có chứa lk đôi
- Đánh số C mạch chính từ phía gần lk đôi hơn.
Gọi tên: vị trí nhánh – tên nhánh – tên C mạch chính – vị trí liên kết đôi – en
Ví dụ: CH2=CH-CH2-CH3 But –1– en
CH3-CH=CH-CH3 But –2–en
Đồng phân
*Đồng phân cấu tạo
- Đồng phân vị trí lk đôi: CH2=CH-CH2-CH3 CH3-CH=CH-CH3
- Đồng phân mạch cacbon:
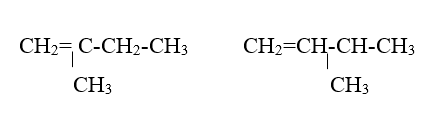
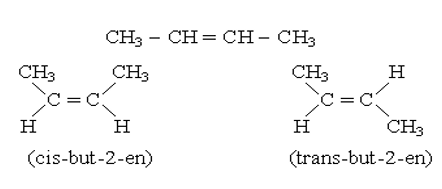
*Đồng phân hình học:
Ví dụ: But-2-en
2. Tính chất hóa học
Phản ứng cộng hiđrô (Phản ứng hiđro hóa)
CH2=CH2 + H2 → CH3-CH3
Phản ứng cộng halogen (Phản ứng halogen hóa)
CH2=CH2 + Br2 → Br – CH2 – CH2– Br
- Anken làm mất màu của dung dịch brom → Phản ứng này dùng để nhận biết anken.
Phản ứng cộng nước và axit
*Cộng axit HX
CH2=CH2 + HCl → CH3CH2Cl
- Đối với các anken khác, nguyên tử halogen (trong HX) mang điện âm, ưu tiên đính vào nguyên tử C bậc cao (theo quy tắc Maccopnhicop).
- Quy tắc Maccopnhicop: Trong phản ứng cộng HX (axit hoặc nước) vào lk C=C của anken, H (phần mang điện tích dương) cộng vào C mang nhiều H hơn, X- (hay phần mang điện tích âm) cộng vào C mang ít H hơn.
*Cộng nước:
CH2=CH2 + H-OH to→ HCH2 – CH2OH
Phản ứng trùng hợp
nCH2=CH2 → [- CH2 – CH2- ]n
- Phản ứng trùng hợp là quá trình cộng hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành phân tử lớn gọi là polime.
- Số lượng mắt xích trong một phân tử polime gọi là hệ số trùng hợp, kí hiệu n
Phản ứng oxi hóa
*Oxi hoá hoàn toàn:
CnH2n + 3n/2O2 to→ nCO2+ nH2O
Nhận xét: đốt anken thu nCO2 = nH2O
*Oxi hoá không hoàn toàn:
3CH2 = CH2 + 4H2O + 2KMnO4 → 3HO – CH2 – CH2 – OH + 2MnO2 + 2KOH
Anken làm mất màu dd KMnO4 → Dùng để nhận biết anken.
3. Điều chế
Trong phòng thí nghiệm:
CH3CH2OH → CH2=CH2 + H2O (170oC)
Trong công nghiệp:
CnH2n+2 to→ CaH2a+2 + CbH2b ( với n = a +b )
C4H10 to→ C2H4 + C2H6
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Hoàn thành phương trình hóa học sau: C2H2 → C2H4. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11









