Hoàn thành phương trình hóa học AgNO3 + HCl
Hoàn thành phương trình hóa học AgNO3 + HCl được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Hoàn thành phương trình hóa học AgNO3 + HCl
Câu hỏi: Hoàn thành phương trình hóa học AgNO3 + HCl
Trả lời:
|
AgNO3 |
+ |
HCl |
→ |
AgCl |
+ |
HNO3 |
|
bạc nitrat |
|
axit clohidric |
|
bạc clorua |
|
axit nitric |
|
Silver nitrate |
|
|
|
|
|
Axit nitric |
|
(dd) |
|
(dd) |
|
(kt) |
|
(dd) |
|
(trắng) |
|
(không màu) |
|
(trắng) |
|
(không màu) |
- Điều kiện phản ứng: không
- Hiện tượng nhận biết: Kết tủa trắng (AgCl)
I. Axit Clohidric (HCl) là gì?
- Axit clohidric hay còn gọi là Acid Hydrocloric có công thức hóa học là HCl, là một axit vô cơ mạnh được tạo thành từ 1 nguyên tử hidro và 1 nguyên tử clo, tạo ra từ sự hòa tan của khí hydro clorua trong nước.
II. Tính chất vật lý của HCl
- Đối với dạng khí, HCl tồn tại không màu, mùi xốc, tan nhiều trong nước tạo thành dung dịch axit mạnh HCl; Nặng hơn không khí.
- Đối với Dung dịch, axit HCl loãng không màu, dung dịch HCl đậm đặc nhất có nồng độ tối đa là 40% và mang màu vàng ngả xanh lá. Ở dạng đậm đặc axit này có thể tạo thành các sương mù axit.
- Độ hòa tan trong nước: 725g / L ở 20°C.
- Trọng lượng phân tử: 36,5g / mol.
- HCl là dung dịch không dễ bốc cháy nhưng dễ bay hơi.
III. Các chất tác dụng với HCl
- Axit clohiđric (HCl) là axit một nấc, tức nó có thể phân ly cho ra một ion H+ và một ion Cl−. Khi hòa tan trong nước, H+ liên kết với phân tử nước tạo thành ion hydronium, H3O+
HCl + H2O → H3O + Cl
- Chính vì khả năng phân ly hoàn toàn trong nước nên nó được xếp vào nhóm axit mạnh và tác dụng được với những chất dưới đây:
Tác dụng với kim loại
Khi tác dụng với kim loại sẽ giải phóng khí H2 đồng thời tạo muối clorua. Lưu ý axit này không tác dụng với những kim loại đứng sau H2 trong dãy hoạt động hóa học:
Fe + 2HCl → FeCl2+ H2
Tác dụng với bazo tạo muối clorua và nước
NaOH + HCl → NaCl + H2O
Tác dụng với muối có gốc anion hoạt động yếu hơn để tạo ra muối mới và axit mới
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Tác dụng với hợp chất có tính oxi hóa
Ngoài khả năng tác dụng với một số kim loại, bazo, muối…axit này còn thể hiện tính oxi hóa khi tham gia phản ứng với KMnO4, K2Cr2O7, MnO2, KClO3…Trong phản ứng này, HCl đóng vai trò là chất khử
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
2HCl + MnO2 → MnCl2 + Cl2↑ + H2O
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
HCl làm quỳ tím chuyển màu
- Với bản chất là 1 axit mạnh, do đó HCl làm cho quỳ tím chuyển sang màu đỏ khi tiếp xúc. Đây cũng là đặc điểm nhận dạng rõ ràng nhất của hầu toàn bộ các axit mạnh.
IV. Điều chế HCl
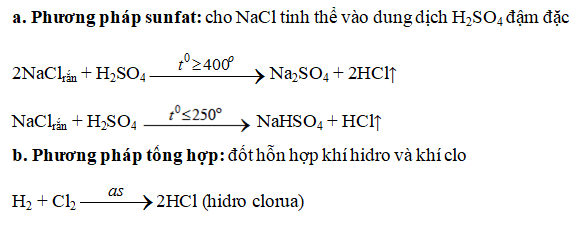
V. Ứng dụng của Axit Clohidric là gì?
- Axit Clohidric là hóa chất hàng đầu được dùng trong nhiều ngành công nghiệp sản xuất, bởi vậy mà sản lượng tiêu thụ chúng lên tới 20 triệu tấn/năm. Một vài ứng dụng nổi bật của hóa chất này phải kể đến như:
+ Tẩy gỉ thép: Để lâu trong môi trường thép sẽ dễ bị oxi hóa dẫn đến hiện tượng gỉ. Để khắc phục vấn đề này, người ta thường dùng HCl có nồng độ 18% để tẩy gỉ các loại thép Carbon, trở thành thép mới.
+ Sản xuất các hợp chất hữu cơ: Axit HCl dùng để sản xuất vinyl clorua và dicloetan để sản xuất ra nhựa PVC hoặc than hoạt tính.
+ Sản xuất các hợp chất vô cơ: HCl có thể sản xuất các hợp chất vô cơ như trợ lắng PAC, muối canxi clorua, niken (II) clorua để mạ điện, bằng phản ứng hóa học. Các chất này được ứng dụng làm chất keo tụ, dùng trong ngành xử lý nước thải, sản xuất giấy và nước uống.
+ Trong công nghiệp khai thác dầu: Axit HCl có thể được dùng để bơm vào trong tầng đá của giếng dầu nhằm hòa tan một phần đá và tạo các lỗ rỗng lớn hơn.
+ Kiểm soát và trung hòa pH: Một trong những ứng dụng quan trọng của axit clohydric đó là xử lý nước đặc biệt là nước bể bơi có nồng độ pH cao vượt ngưỡng 7,6. HCl 32 có tác dụng làm giảm độ pH trong nước một cách hiệu quả. Lưu ý: Không được thêm trực tiếp hóa chất HCl 32 khi mọi người vẫn còn ở trong hồ bơi.
+ Ứng dụng khác: Ngoài ra Axit HCl còn có ứng dụng khác như xử lý da, vệ sinh nhà cửa và xây dựng nhà.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Hoàn thành phương trình hóa học AgNO3 + HCl. Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11










