Đồng phân C8H10 - Công thức phân tử và cách gọi tên
Chúng tôi xin giới thiệu bài Đồng phân C8H10 - Công thức phân tử và cách gọi tên được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình Hóa học 11 áp dụng cho cả 3 bộ sách: Chân trời sáng tạo, Kết nối tri thức và Cánh diều.
Đồng phân C8H10
Đồng phân C8H10 - Công thức phân tử và cách gọi tên
Hướng dẫn trả lời
C8H10 có độ bất bão hòa
![]()
⇒ (1 vòng + 3 liên kết pi trong vòng)
Ứng với công thức phân tử C8H10 thì chất là hiđrocacbon thơm:
|
STT |
Công thức cấu tạo |
Tên gọi |
|
1 |
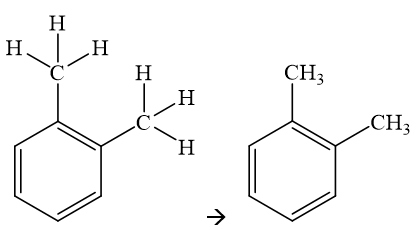 |
o – xylen/ 1,2 – dimethylbenzene/ o – đimethylbenzene. |
|
2 |
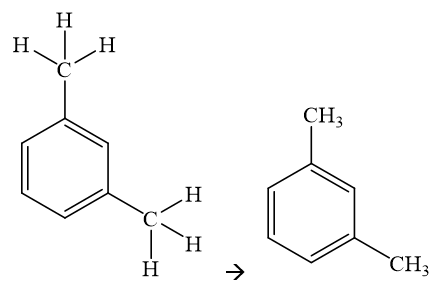 |
m – xylen/ 1,3 – dimethylbenzene/ o – dimethylbenzen . |
|
3 |
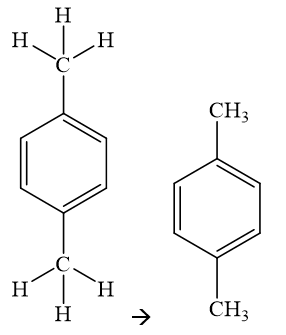 |
p – xylen/ 1,4 – dimethylbenzene/ p – dimethylbenzene. |
|
4 |
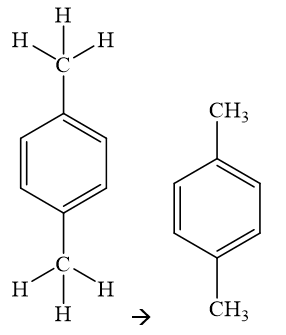 |
ethylbenzene |
Vậy ứng với công thức phân tử C8H10 có 4 đồng phân hydrocarbon thơm.
I. Khái niệm độ bất bão hòa
Độ bất bão hòa (k) là đại lượng đặc trưng cho mức độ chưa no của một hợp chất hữu cơ, được tính bằng tổng số liên kết π và số vòng trong CTCT.
II. Công thức tính độ bất bão hòa hợp chất hữu cơ
Xét hợp chất có công thức: CxHyOzNtXr ( X là halogen)
Độ bất bão hòa
![]()
III. Kiến thức mở rộng
- Công thức tính độ bất bão hòa chỉ áp dụng cho hợp chất cộng hóa trị.
- Các nguyên tố hóa trị II như oxi, lưu huỳnh không ảnh hưởng tới độ bất bão hòa.
- Một số dạng/công thức thường gặp:
+ CnH2n+2 (chỉ chứa nối đơn, mạch hở)
+ CnH2n (có 1 nối đôi, mạch hở hoặc vòng no)
+ CnH2n-2 (có 1 nối ba, mạch hở hoặc 2 nối đôi, mạch hở hoặc 1 nối đôi 1 vòng …)
+ CnH2n-6 (chứa vòng benzene …)
+ CxHyO (dạng R-OH; R-O -R’, R-CHO, R-CO-R’)
+ CxHyO2 (dạng R-COOH, R-COO -R’, HO-R-CHO…)
+ CxHyN (dạng R-NH2; R1-NH-R2,...)
IV. Ứng dụng của độ bất bão hòa
1. Xác định số đồng phân
- Để xác định được số đồng phân của một chất hữu cơ, nhất thiết phản phân tích được đặc điểm của các thành phần cấu tạo nên chất hữu cơ đó (gốc, nhóm chức), trong đó có các đặc điểm về mạch C và loại nhóm chức.
- Để xác định được các đặc điểm này, vai trò của k là rất quan trọng, thể hiện qua biểu thức:
kphân tử = kmạch + knhóm chức
VD1: số đồng phân của C4H10O (7 đồng phân = 4 rượu + 3 ete).
VD2: số đồng phân của C4H8O.
2. Xác định CTPT từ CT thực nghiệm
Xác định CTPT chất hữu cơ là yêu cầu phổ biến và cơ bản nhất của bài tập Hóa hữu cơ. Có nhiều phương pháp để xác định CTPT chất hữu cơ (trung bình, bảo toàn nguyên tố, bảo toàn khối lượng, …), tùy thuộc vào đặc điểm số liệu của bài toán đưa ra. Trong bài học này, ta xét trường hợp đề bài yêu cầu xác định CTPT từ CT thực nghiệm mà không cho KLPT của chất hữu cơ đó.
Cách làm: gồm 3 bước:
Bước 1: Từ CT thực nghiệm, viết lại CTPT theo n
VD: Công thức thực nghiệm của một acid hữu cơ (C2H3O2)n có thể viết lại là C2nH3nO2n .
Bước 2: Tính k theo n.
Bước 3: So sánh giá trị k tìm được với đặc điểm Hóa học của chất hữu cơ đã cho hoặc tính chất của k.
3. Sử dụng số liên kết π trung bình
Áp dụng cho các bài toán Hóa hữu cơ mà các chất trong hỗn hợp: khác nhau về số liên kết π, có thể xác định được số liên kết π trung bình thông qua tỷ lệ số mol của hỗn hợp trong các phản ứng định lượng số liên kết π (phản ứng cộng H2, Br2, ...), hay gặp nhất là các bài toán hỗn hợp gồm alkane và alkyne hoặc alkene và alkyne, ...
4. Phân tích hệ số trong các phản ứng đốt cháy
Ta đã biết một chất hữu cơ bất kỳ chứa 3 nguyên tố C, H, O có CTPT là bão hòa (bằng tổng số vòng và số liên kết π trong CTCT).
Xét phản ứng cháy của hợp chất này, ta có:
Cn H2n+2-2k Ox → nCO2+ (n+1-k)H2O
Phân tích hệ số phản ứng này, ta có một kết quả rất quan trọng là:
Với nX là số mol chất hữu cơ bị đốt cháy.
2 trường hợp riêng hay gặp trong các bài tập phổ thông là:
k = 0 (hợp chất no, mạch hở CnH2n+2Ox) có nX = nH2O - nCO2 (alkane, rượu no mạch hở, ete no mạch hở, ...)
k = 2 có nX = nCO2 - nH2O (alkyne, alkadiene, acid không nó có 1 nối đôi, Aldehyde không nó 1 nối đôi, Keton không no 1 nối đôi, ...)
Kết quả này cũng có thể mở rộng cho cả các phản ứng cháy của hợp chất hữu cơ chứa Nitơ.










