Phương trình Phenol ra Picric acid
Phương trình Phenol ra Axit Picric được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Phương trình phenol ra Picric acid?
Phương trình phenol ra Picric acid?
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
Hay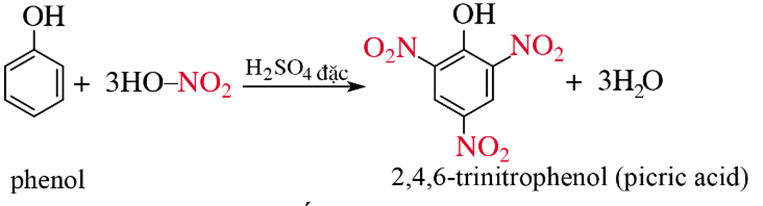
I. Phenol là gì? Phân loại như thế nào?
1. Khái niệm
- Phenol là những hợp chất hữu cơ trong phân tử có một hay nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene.
- Chú ý: Phenol đơn giản nhất là C6H5OH có tên là phenol.
2. Phân loại
- Những phenol trong phân tử chứa một nhóm –OH thuộc monophenol. Ví dụ:
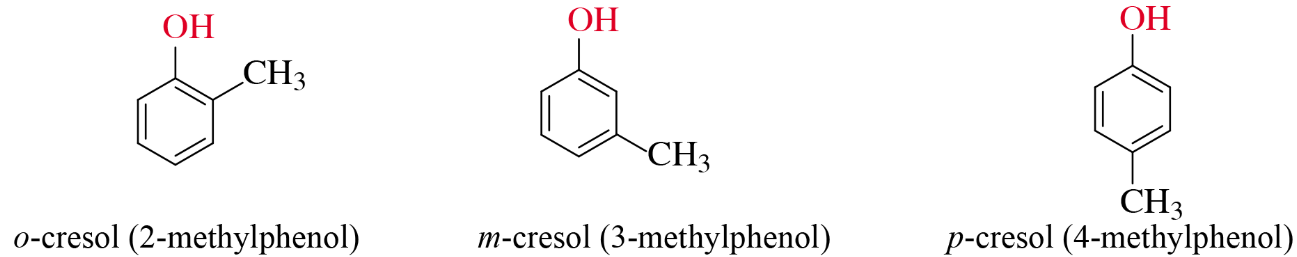
- Những phenol trong phân tử chứa nhiều nhóm –OH thuộc loại polyphenol. Ví dụ:
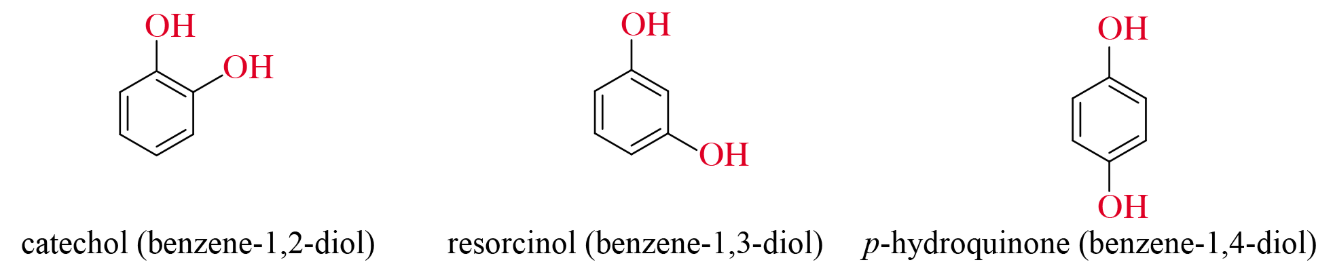
II. Tính chất vật lí
Ở điều kiện thường, phenol là chất rắn, không màu, nóng chảy ở 43 oC.
- Phenol có nhiệt độ nóng chảy và nhiệt độ sôi cao hơn các aryl halide có phân tử khối tương đương do tạo được liên kết hydrogen giữa các phân tử.
- Phenol ít tan trong nước lạnh (dù tạo được liên kết hydrogen với nước), tan vô hạn ở 66 oC và tan tốt trong các dung môi hữu cơ.
- Phenol có dễ bị chảy rữa, rất độc và dễ gây bỏng khi tiếp xúc với da do đó cần tuyệt đối cẩn thận khi làm thí nghiệm với phenol.
- Liên kết hydrogen giữa các phân tử phenol (a) và giữa phân tử phenol với nước (b) được thể hiện trong hình sau:
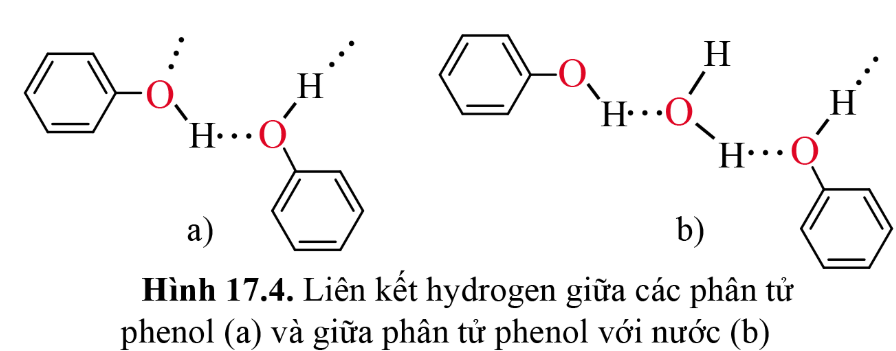
III. Tính chất hóa học
Do ảnh hưởng qua lại giữa nhóm – OH và vòng benzene, phenol có phản ứng thế nguyên tử H ở nhóm – OH (thể hiện tính acid) và phản ứng thế nguyên tử H của vòng benzen.
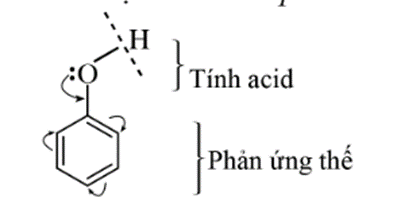
2.1. Tính acid của phenol
- Phenol thể hiện tính acid yếu. Dung dịch phenol không làm đổi màu quỳ tím.
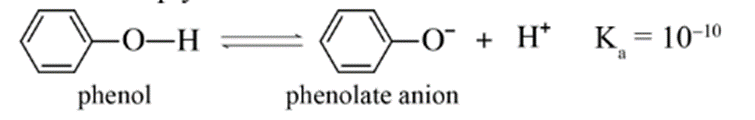
a) Phản ứng với dung dịch NaOH
Phenol ít tan trong nước, nhưng tan tốt trong dung dịch sodium hydroxide do có phản ứng: C6H5OH + NaOH → C6H5ONa + H2O.
b) Phản ứng với dung dịch sodium carbonat
C6H5OH + Na2CO3 ⇌ C6H5ONa + NaHCO3
Kết luận: Tính acid của phenol mạnh hơn tính acid của alcohol.
2.2. Phản ứng thế nguyên tử H của vòng benzene
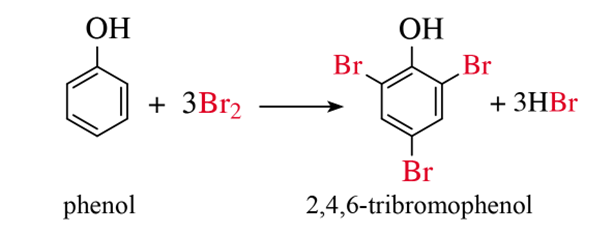
a) Phản ứng với nước bromine
- Nhỏ nước bromine vào dung dịch phenol, thấy xuất hiện kết tủa trắng.
Phương trình hoá học:
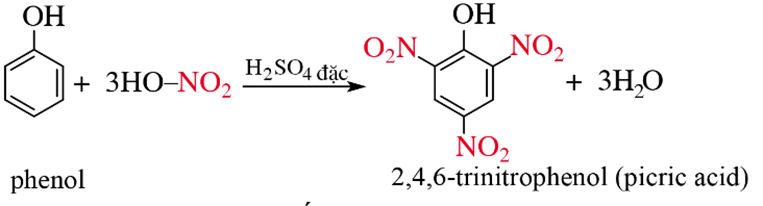
b) Phản ứng với dung dịch HNO3 đặc
IV. Điều chế Phenol ra sao?
Từ xa xưa, phenol được điều chế từ nhựa than đá. Thế nhưng hiện nay, chúng được sản xuất trên quy mô lớn (khoảng 7 tỷ kg/năm) từ các nguyên liệu có nguồn gốc từ dầu mỏ.
+ Nguồn phenol chủ yếu lấy từ sản phẩm chưng cất than đá.
Ngoài ra có thể điều chế từ benzene:
C6H6 + Br2 → C6H5Br+ HBr (xúc tác bột Fe)
C6H5Br + 2NaOH (đặc) -> C6H5ONa + NaBr + H2O (nhiệt độ và áp suất cao)
C6H5ONa + CO2 + H2O -> C6H5OH + NaHCO3
V. Phenol có những ứng dụng nào?
Phenol được ứng dụng trong nhiều lĩnh vực đa dạng khác nhau:
+ Công nghiệp chất dẻo: phenol là nguyên liệu để sản xuất nhựa phenol formaldehyde.
+ Công nghiệp tơ hóa học: Từ phenol tổng hợp ra tơ polyamide.
+ Hóa chất này dùng để điều chế chất diệt cỏ dại và chất kích thích sinh trưởng thực vật, kích thích tố thực vật 2,4 – D (là muối sodium của 2,4-Dichlorophenoxyacetic acid).
+ Phenol cũng là nguyên liệu để điều chế một số phẩm nhuộm, thuốc nổ (picric acid).
+ Do có tính diệt khuẩn nên phenol được dùng để trực tiếp làm chất sát trùng hoặc để điều chế các chất diệt nấm mốc, diệt sâu bọ (ortho – và para – nitrophenol…)
-------------------------------------------










