Bậc của Ancol là?
Chúng tôi xin giới thiệu bài Bậc của Ancol là? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Bậc của ancol là
Câu hỏi: Bậc của ancol là
- bậc cacbon lớn nhất trong phân tử.
- bậc của cacbon liên kết với nhóm -OH.
- số nhóm chức có trong phân tử.
- số cacbon có trong phân tử ancol.
Lời giải:
Đáp án đúng là: B. bậc của cacbon liên kết với nhóm -OH.
Giải thích:
Theo định nghĩa, bậc của ancol là bậc của Cacbon chứa nhóm –OH, bậc của cacbon chứa nhóm OH là số nguyên tử Cacbon liên kết với nguyên tử Cacbon chứa nhóm OH đó
I. Định nghĩa Ancol là gì?
Ancol hay còn được gọi với cái tên quen thuộc là rượu. Chúng là một hợp chất hữu cơ có chứa nhóm –OH được gắn vào một nguyên tử cacbon nhưng đến lượt nó thì lại gắn với một nguyên tử hydro hay cacbon khác.
Cấu trúc của ancol gồm nhóm chức hydroxyl -OH gắn với cacbon lai sp³. Còn gọi là nhóm chức ancol.
1. Phân loại
a) Ancol no, đơn chức, mạch hở
Phân tử có một nhóm -OH liên kết với gốc ankyl: CnH2n+1−OH
b) Ancol không no, đơn chức, mạch hở
Phân tử có một nhóm -OH liên kết với nguyên tử cacbon no của gốc hiđrocacbon không no.
c) Ancol thơm, đơn chức
Phân tử có nhóm -OH liên kết với nguyên tử cacbon no thuộc mạch nhánh của vòng benzen.
d) Ancol vòng no, đơn chức
Phân tử có một nhóm -OH liên kết với nguyên tử cacbon no thuộc gốc hiđrocacbon vòng no.
e) Ancol đa chức
Phân tử có hai hay nhiều nhóm -OH ancol.
2. Đồng phân và danh pháp
Đồng phân
- Mạch cacbon khác nhau.
- Vị trí của các nhóm –OH khác nhau.
- Ngoài ra ancol đơn chức có đồng phân là ete: R-O-R’.
Ví dụ: Viết đồng phân của C3H8O.
Danh pháp
- Tên thông thường: Tên ancol = tên gốc hiđrocacbon no tương ứng + ic.
Ví dụ:
CH3-CH2-OH: ancol etylic.
CH3-OH: ancol metylic.
- Tên thay thế: Tên ancol = tên gốc hiđrocacbon no tương ứng + ol.
II. Tính chất vật lý
Trạng thái tồn tại: Từ C1 đến C12 là chất lỏng, từ C13 trở lên là chất rắn.
- Nhiệt độ sôi
+ So với các chất có M tương đương thì nhiệt độ sôi của: Muối > Axit > Ancol > Anđehit > Hiđrocacbon, ete và este…
+ Nhiệt độ sôi của một chất thường phụ thuộc vào các yếu tố:
+ M: M càng lớn thì nhiệt độ sôi càng cao.
+ Độ phân cực của liên kết: liên kết ion > liên kết cộng hóa trị có cực > liên kết cộng hóa trị không cực.
+ Số liên kết hiđro: càng nhiều liên kết H thì nhiệt độ sôi càng cao.
+ Độ bền của liên kết hiđro: liên kết H càng bền thì nhiệt độ sôi càng cao.
- Độ tan
+ Ancol có 1, 2, 3 nguyên tử C trong phân tử tan vô hạn trong nước.
+ Ancol có càng nhiều C, độ tan trong nước càng giảm vì tính kị nước của gốc hiđrocacbon tăng.
III. Tính chất hóa học
Ancol phản ứng với kim loại kiềm (Ancol + Na)
- Phản ứng của Ancol + Na
R(OH)z + zNa → R(ONa)z + z/2H2
- Ancol hầu như sẽ không phản ứng được cùng với NaOH nhưng natri ancolat sẽ bị phân hủy hoàn toàn. Cụ thể:
R(ONа)z + zH2O → R(OH)z + zNaOH
Chú ý:
+ Trong phản ứng của ancol với Na thì:
mbình Na tăng = mAncol – mH2 = nAncol.(MR + 16z)
mbình Ancol tăng= mNa – mH2 = nAncol.22z
+ Nếu chúng ta cho dung dịch ancol phản ứng với Na thì bên cạnh phản ứng của ancol còn có phản ứng của H2O với Na.
+ Số nhóm chức Ancol = 2.nH2/nAncol
Tính chất đặc trưng của glixerol
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + H2O
(ĐK: muốn tác dụng với Cu(OH)2 phải có 2 nhóm -OH trở lên liền kề nhau)
→ Phản ứng này dùng để phân biệt ancol đơn chức với ancol đa chức có 2 nhóm OH cạnh nhau trong phân tử.
Ancol phản ứng với axit
- Ancol phản ứng với axit vô cơ HX (Ancol + H2SO4, Ancol + HCl)
CnH2n+2-2k-z(OH)z + (z+k)HX -> CnH2n+2-zXz+k
Trong đó: số nguyên tử X sẽ bằng tổng số nhóm OH và số liên kết pi
- Ancol phản ứng với axit hữu cơ (phản ứng este hóa)
ROH + R’COOH ⇔ R’COOR + H2O
yR(OH)x + xR’(COOH)y ⇔ R’x(COO)xyRy + xyH2O
Chú ý:
+ Phản ứng phải được thực hiện trong môi trường axit và đun nóng.
+ Phản ứng có tính thuận nghịch vì thế cần chú ý đến chuyển dịch cân bằng.
Phản ứng tách nước
Tách nước từ 1 phân tử ancol tạo anken của ancol no, đơn chức, mạch hở
CnH2n+1OH = CnH2n + H2O (H2SO4 đặc, >170 độ C)
- Điều kiện của ancol khi tham gia phản ứng này là phải có Hg.
- Nếu ancol no, đơn chức mạch hở không tách nước tạo anken thì Ancol đó không có Ha (là CH3OH hoặc ancol mà nguyên tử C liên kết với OH chỉ liên kết với C bậc 3 khác).
- Nếu một ancol tách nước tạo ra hỗn hợp nhiều anken thì đó là ancol bậc cao (bậc II, bậc III) và mạch C không đối xứng qua c liên kết với OH.
- Nhiều ancol tách nước tạo ra một anken thì xảy ra các khả năng sau:
- Các phản ứng tách nước đặc biệt:
CH2OH-CH2OH → CH3CHO + H2O
CH2OH-CHOH-CH2OH → CH2=CH-CHO + 2H2O
Tách nước từ 2 phân tử ancol tạo ete
ROH + ROH → ROR + H2O (H2SO4 đặc, 140 độ C)
Chú ý:
+ Từ n ancol khác nhau khi tách nước ta thu được n.(n + 1)/2 ete trong đó có n ete đối xứng.
+ Nếu tách nước thu được các ete có số mol bằng nhau thì các ancol tham gia phản ứng cũng có số mol bằng nhau và nAncol = 2.nete = 2.nH2O và mAncol = mete + mH2O + mAncol dư
Phản ứng oxi hóa (Ancol + O 2 )
- Oxi hóa hoàn toàn
CxHyOz + (x + y/4 – z/2)O2 → xCO2 + y/2H2O
Chú ý:
– Phản ứng đốt cháy của ancol sẽ có đặc điểm tương tự với phản ứng đốt cháy hidrocacbon tương ứng.
+ Nếu chúng ta đốt cháy ancol và cho nH2O > nCO2 thì ancol đem đốt cháy là ancol no và nAncol = nH2O – nCO2.
+ Nếu khi đốt cháy ancol cho nH2O > 1,5.nCO2 thì ancol là CH3OH. Chỉ có CH4 và CH3OH có tính chất này (không kể amin).
Khi đốt cháy 1 hợp chất hữu cơ X thấy nH2O > nCO2 = chất đó là ankan, ancol no mạch hở hoặc ete no mạch hở (cùng có công thức CnH2n+2O4).
Oxi hóa không hoàn toàn (Ancol + CuO hoặc Ox có xúc tác là Cu)
+ Ancol bậc l + Cuo tạo anđehit: RCH2OH + CuORCHO + Cu + H2O
+ Ancol bậc II + CuO tạo xeton: RCHOHR’ + CuO – RCOR’ + Cu + H2O
+ Ancol bậc III không bị oxi hóa bằng CuO.
Chú ý là: mchất rắn giảm = mCuO phản ứng – mCu tạo thành = 16.nAncol đơn chức
IV. Ứng dụng và điều chế
1. Ứng dụng
- Methanol chủ yếu được dùng để sản xuất Andehit Fomic nguyên liệu cho công nghiệp chất dẻo.
- Ethanol được dùng để điều chế một số hợp chất hữu cơ như axit axetic, dietyl ete, etyl axetat, … do có khả năng hòa tan tốt một số hợp chất hữu cơ nên Ethanol được dùng để pha vecni, dược phẩm, nước hoa…
- Trong đời sống hàng ngày Ethanol được dùng để pha chế các đồ uống với độ ancol khác nhau.
2. Điều chế
Phương pháp tổng hợp
![]()
Ví dụ: Điều chế etanol từ etilen CH2=CH2 + H2O → CH3CH2OH
Phương pháp sinh hoá: từ tinh bột, đường, ...
![]()
Điều chế metanol trong công nghiệp
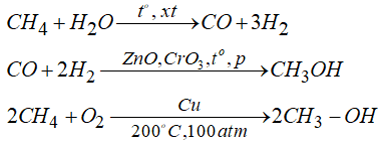
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Bậc của Ancol là? Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11










